Biotechnologies et génétique humaine
BIOTECHNOLOGIE ET GÉNÉTIQUE HUMAINE
L'accumulation des connaissances sur les gènes impliqués dans les maladies héréditaires a permis d'améliorer le dépistage et le diagnostic génétique. Les espoirs de thérapie génique commencent à se confirmer.
1 Evaluation d'un risque génétique sur des bases phénotypiques
Le conseil génétique consiste à évaluer le risque, pour un couple, de donner naissance à un enfant atteint d'une maladie génétique ou d'une anomalie chromosomique. Il faut, pour fonder son évaluation, s'appuyer sur une analyse précise de l'arbre généalogique de la famille.
1.1 LE RISQUE D'ÊTRE ATTEINT D'UNE MALADIE AUTOSOMALE
1.1.1 La mucoviscidose:
C'est la maladie héréditaire la plus fréquente du monde occidental (1 enfant sur 2 500 environ en est atteint: fréquence phénotypique), elle se manifeste par des syndromes divers ayant tous en commun une concentration anormale en NaCl dans la sueur. Un défaut de perméabilité aux ions Cl- existe dans les cellules de l'épithélium digestif et respiratoire.
L'allèle responsable de la maladie résulte de mutations d'un gène (maladie monogénique) porté par la paire de chromosomes n°7. Il entraîne la synthèse d'une protéine anormale (CFTR: Cystic Fibrosis Transmembrane Regulator) ne permettant plus le fonctionnement normal des canaux à Cl-. Des troubles respiratoires en découlent, qui sont dus à une obstruction des bronches par du mucus.
Aucun traitement n'existe actuellement, mais un suivi thérapeutique augmente l'espérance de vie des malades.
On estime qu'en France 4% de la population possède un allèle muté (fréquence allélique).
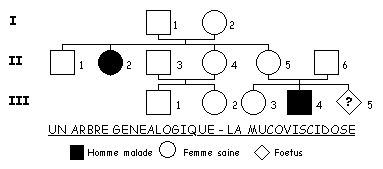
![]() Considérons une famille où sévit la mucoviscidose comme l'indique l'arbre généalogique ci-contre. Comme nous l'avons appris dans le chapitre "Méiose et fécondation, à l'origine du brassage génétique (§2.2)" de la partie obligatoire, nous adopterons la démarche d'analyse suivante:
Considérons une famille où sévit la mucoviscidose comme l'indique l'arbre généalogique ci-contre. Comme nous l'avons appris dans le chapitre "Méiose et fécondation, à l'origine du brassage génétique (§2.2)" de la partie obligatoire, nous adopterons la démarche d'analyse suivante:
1 - vous commencerez par déterminer l'allèle récessif et l'allèle dominant en prenant bien en compte que la récessivité ne dépend absolument pas de la fréquence de l'allèle dans l'arbre. Pour ce faire, comme nous l'avons vu, vous vous intéresserez aux couples dont les enfants n'ont pas le même phénotype que leurs parents.
2 - Vous justifierez la transmission par autosomie:
d'une part avec les données accompagnant la présentation de la maladie,
d'autre part en argumentant à partir de l'arbre.
3 - Après avoir établi le génotype des parents II-5 et II-6 vous déterminerez le risque, pour ce couple, d'avoir son troisième enfant atteint de mucoviscidose.
*****
4 - A titre subsidiaire, vous direz quelle est, à priori, la probabilité pour que les deux membres d'un couple soient tous les deux hétérozygotes. Vous expliquerez alors la fréquence phénotypique moyenne de la maladie dans le monde occidental.
5 - Quel est le risque encouru par l'individu II-1 d'avoir lui aussi un enfant atteint de mucoviscidose, en admettant que sa compagne n'a pas d'antécédents familiaux connus?
1.1.2 La chorée de Huntington:
C'est une maladie héréditaire rare qui se manifeste, tardivement vers 40 ans, par des troubles moteurs caractérisés par des mouvements brusques et incohérents, des troubles de la mémoire pouvant aller jusqu'à la démence.
Ces troubles sont dus à une dégénérescence des neurones de plusieurs zones du cortex et du tronc cérébral.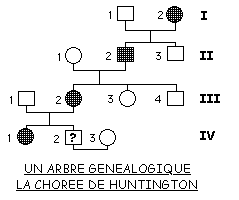 Le locus du gène de la Chorée de Huntington (maladie monogénique) est situé sur le bras court de la 4e paire d'autosomes. Il est actuellement possible de dépister la présence de ce gène autosomal, qui se transmet selon le mode dominant.
Le locus du gène de la Chorée de Huntington (maladie monogénique) est situé sur le bras court de la 4e paire d'autosomes. Il est actuellement possible de dépister la présence de ce gène autosomal, qui se transmet selon le mode dominant.
![]() Dans le cas présent, il sera nécessaire de considérer la rareté de la maladie pour justifier une transmission selon le mode dominant, ce que vous essaierez de faire.
Dans le cas présent, il sera nécessaire de considérer la rareté de la maladie pour justifier une transmission selon le mode dominant, ce que vous essaierez de faire.
Dites pourquoi le recours au dépistage est une décision lourde de conséquence, par exemple pour l'individu IV-2.
1.2 LE RISQUE D'ÊTRE ATTEINT D'UNE MALADIE GONOSOMALE
La myopathie de Duchenne
Il s'est vite révélé aux généticiens que certaines maladies génétiques touchaient beaucoup plus fréquemment les garçons que les filles. c'est le cas de la Myopathie de Duchenne.
Il s'agit d'une maladie caractérisée par la dégénérescence progressive des muscles. De rares cas affectent les filles, mais les garçons en sont atteints à raison de 1 cas sur 3 500 environ.
Se manifestant d'abord par une faiblesse musculaire des jambes, la maladie s'aggrave vers 10 ans et l'enfant devient incapable de se déplacer. On ne dispose pas encore à l'heure actuelle de moyens de guérison.
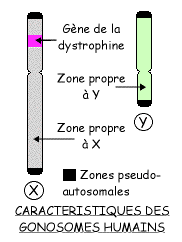 Le gène responsable de la maladie gouverne la synthèse d'une protéine musculaire: la dystrophine. Des mutations (le plus souvent par délétion) engendrent la production d'une protéine non fonctionnelle.
Le gène responsable de la maladie gouverne la synthèse d'une protéine musculaire: la dystrophine. Des mutations (le plus souvent par délétion) engendrent la production d'une protéine non fonctionnelle.
Sa situation dans une zone particulière du chromosome X permet d'expliquer l'échéance liée au sexe de la maladie. En effet, les deux gonosomes, dans l'espèce humaine, sont très différents:
- le chromosome X , de grande taille, porte 2 à 3 milliers de gènes,
- le chromosome Y, de petite taille, n'en porte que quelques dizaines.
Les deux extrémités de ces chromosomes sont homologues, c'est-à-dire que les quelques gènes qu'ils portent sont présents en deux exemplaires chez l'homme, comme chez la femme.
Par contre la majeure partie, centrale, des deux chromosomes ne sont pas homologues.
Le gène de la dystrophine a été localisé dans la partie propre du chromosome X.
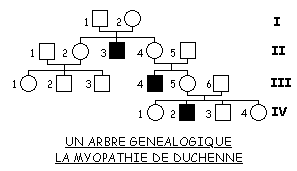
![]() Dans un tableau à deux entrées (phénotypes / génotypes), vous formulerez de manière littérale classique et par représentation chromosomique les caractéristiques d'un sujet masculin sain, d'un sujet masculin atteint de myopathie, celles d'un sujet féminin sain, d'un sujet féminin malade.
Dans un tableau à deux entrées (phénotypes / génotypes), vous formulerez de manière littérale classique et par représentation chromosomique les caractéristiques d'un sujet masculin sain, d'un sujet masculin atteint de myopathie, celles d'un sujet féminin sain, d'un sujet féminin malade.
Vous essaierez d'expliquer la transmission de la maladie dans la famille représentée par l'arbre généalogique.
Pour le couple III-5 et III-6 vous déterminerez comment l'on pouvait estimer le risque d'avoir un enfant atteint de la myopathie (IV-2 ) avant sa naissance, après cette naissance.
2 Dépistage d'une anomalie génique par diagnostic génotypique
La méthode classique d'évaluation du risque génétique, que nous venons de voir est basée sur la détermination du fait qu'un individu est homozygote ou hétérozygote pour deux allèles d'un même gène, l'un normal, l'autre muté. En réalité on aboutit à des conclusions qui restent hypothétiques si plusieurs allèles sont à l'origine du phénotype normal ou d'un même phénotype clinique, ou encore si des allèles de deux gènes différents entraînent deux phénotypes cliniques voisins.
2.1 PRESENTATION DE LA METHODE
L'analyse génétique des individus d'un arbre généalogique peut permettre de confirmer ou non les conclusions tirées de l'analyse classique.
Sans entrer dans le détail de la technique du diagnostic prénatal, celle-ci fait intervenir:
le prélèvement de cellules embryonnaires par amniocentèse (étudiée dans la partie obligatoire), dans le but d'analyser l'ADN du foetus et de le comparer à celui des parents et des autres enfants,
l'amplification par PCR ("Polymerisation chain reaction" qui n'est pas strictement du programme) d'une séquence du gène incriminé, qui permet d'obtenir très rapidement in vitro de grandes quantités de l'ADN que l'on veut analyser,
le découpage de cet ADN par des enzymes de restriction,
l'électrophorèse des fragments d'ADN qui révéleront ou non la mutation.
Nous aurons recours au logiciel "ANAGENE" qui, à partir d'une banque de données, permettra de déterminer les génotypes des membres d'une famille étudiée.
Ce type d'étude (comparaison des allèles d'un individus avec un allèle de référence) a déjà été réalisé dans la partie obligatoire à propos du polymorphisme génique.
Nous la compléterons avec l'utilisation simplifiée des méthodes de diagnostic génotypique à l'aide des enzymes de restriction.
2.2 UN EXEMPLE: L'ALBINISME OCULO-CUTANE
2.2.1 L'albinisme oculo-cutané humain (OCA) est une anomalie héréditaire de la pigmentation: le phénotype macroscopique visible est un défaut de pigmentation de la peau, des poils et des yeux dû à une réduction ou une absence de synthèse de la mélanine.
L'une des formes de cette anomalie est liée à un gène autosomal récessif situé sur le chromosome 11: elle échoit avec une fréquence de 1 cas sur 20 000 environ (aux USA).
La pigmentation résulte de processus complexes. Chez certains albinos, l'insuffisance de mélanine peut être due à une anomalie dans la chaîne de biosynthèse de cette molécule (anomalie enzymatique) où la tyrosinase joue un rôle important. Certains allèles du gène de la tyrosinase sont à l'origine de l'albinisme oculo-cutané dit de type 1 (OCA-1).
Les enfants naissent avec les cheveux blancs, la peau blanche, les yeux bleus et ces caractères persistent pendant toute la vie. la peau ne bronze pas et reste très sensible au soleil.
Le séquençage du gène a montré que l'allèle normal présentait un polymorphisme: dans l'exemple que nous analyserons, nous ne retiendrons que quatre allèles:
Tyrcod1 et Tyrcod2, les allèles normaux qui gouvernent la tyrosinase fonctionnelle,
Tyralba1 et Tyralba2, deux allèles mutés, à l'origine d'enzymes totalement inactives.
2.2.2 Analyse classique d'un cas d'albinisme dû à des allèles différents du gène de la tyrosinase
![]()
![]() 1 - Ouvrez le logiciel ANAGENE et choisissez dans "Programmes et documents": "HEREDITE DE L'ALBINISME".
1 - Ouvrez le logiciel ANAGENE et choisissez dans "Programmes et documents": "HEREDITE DE L'ALBINISME".
2- Choisissez "Arbre 1 avec sujets atteints d'albinisme".
3 - Montrez à l'aide de l'arbre proposé qu'il s'agit d'une hérédité autosomale récessive.
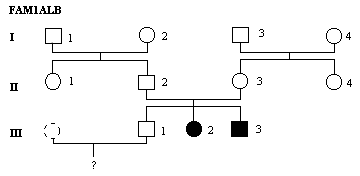 4 - Déterminez les génotypes possibles des individus en désignant par S l'allèle sain (tyrosinase fonctionnelle) et par a l'allèle à l'origine de l'albinisme.
4 - Déterminez les génotypes possibles des individus en désignant par S l'allèle sain (tyrosinase fonctionnelle) et par a l'allèle à l'origine de l'albinisme.
5 - Vous calculerez la probabilité qu'a un couple d'avoir un enfant albinos:
vous rechercherez, pour ce faire, la probabilité qu'a III-1 d'avoir un enfant albinos sachant que sa compagne ne présente aucun antécédent d'albinisme dans sa famille et que dans la population la fréquence allélique de l'albinisme est de 1%.
2.2.3 Analyse génotypique:
Cette analyse va permettre de tester les hypothèses émises sur le génotype des individus, par exemple le génotype de III-1, et d'affiner le calcul de probabilité de naissance d'un individu albinos.
Reconnaissance des allèles Tyrcod1 et Tyrcod2 par la méthode des enzymes de restriction:
![]()
![]() 1 - Dans le logiciel ANAGENE, choisissez dans "Thèmes d'étude": "L'albinisme" et "Arbre 1 avec sujets atteints d'albinisme": vous accédez aux séquences des différents allèles. Sélectionnez Tyrcod1 et Tyrcod2 et comparez ces séquences. Quelle(s) différence(s) les sépare(nt)?
1 - Dans le logiciel ANAGENE, choisissez dans "Thèmes d'étude": "L'albinisme" et "Arbre 1 avec sujets atteints d'albinisme": vous accédez aux séquences des différents allèles. Sélectionnez Tyrcod1 et Tyrcod2 et comparez ces séquences. Quelle(s) différence(s) les sépare(nt)?
2- Dans "Programmes et documents": "HEREDITE DE L'ALBINISME", choisissez "Nombre de sites reconnus par les enzymes": repérez une (ou des) enzyme(s) susceptible(s) de différencier les deux allèles.
Vérifiez votre conclusion en faisant agir cette enzyme sur les deux séquences grâce au bouton ![]() "Action enzymatique" et en choisissant l'option "Graphique". Que constatez-vous?
"Action enzymatique" et en choisissant l'option "Graphique". Que constatez-vous?
3 - Pour bien saisir la signification des résultats trouvés avec le logiciel, vous rechercherez, après avoir sélectionné chacun des allèles et utilisé le bouton ![]() "Info", le nombre de sites et la longueur des fragments de restriction.
"Info", le nombre de sites et la longueur des fragments de restriction.
Vous ferez une représentation schématique pour chaque allèle dans le but de faire l'analogie avec une électrophorèse.
Reconnaissance des allèles Tyralba1 et Tyralba2:
![]()
![]() Vous ferez la même étude pour les deux allèles Tyralba1 et Tyralba2 à l'origine de l'albinisme de certains membres de la famille considérée.
Vous ferez la même étude pour les deux allèles Tyralba1 et Tyralba2 à l'origine de l'albinisme de certains membres de la famille considérée.
Ainsi, vous disposez de toutes les informations pour identifier tel ou tel allèle.
Détermination de génotypes de l'arbre généalogique:
Vous pouvez à présent tester les hypothèses sur les génotypes de la famille étudiée et faire des prévisions sur le phénotype d'un descendant.
![]()
![]() Vous concentrerez votre analyse génotypique sur les individus III-1, III-2 et III-3. Pour cela sélectionnez dans le tableau "Arbre 1 avec sujets atteints d'albinisme" du "Thème d'étude: l'albinisme" les allèles correspondant à ces individus et faites agir les enzymes de restriction du fichier "enztyr" (tableau ci-dessus).
Vous concentrerez votre analyse génotypique sur les individus III-1, III-2 et III-3. Pour cela sélectionnez dans le tableau "Arbre 1 avec sujets atteints d'albinisme" du "Thème d'étude: l'albinisme" les allèles correspondant à ces individus et faites agir les enzymes de restriction du fichier "enztyr" (tableau ci-dessus).
Vous reporterez vos résultats dans un tableau:
|
ALLELLES DES INDIVIDUS |
NOMBRE DE SITES RECONNUS PAR LES ENZYMES |
ALLELES DU GENE | ||||||
|
|
|
|
|
|
|
|
|
|
|
F1-iii1 all1.tyr |
|
|
|
|
|
|
|
|
|
F1-iii1 all2.tyr |
|
|
|
|
|
|
|
|
|
F1-iii2 all1.tyr |
|
|
|
|
|
|
|
|
|
F1-iii2 all2.tyr |
|
|
|
|
|
|
|
|
|
F1-iii3 all1.tyr |
|
|
|
|
|
|
|
|
|
F1-iii3 all2.tyr |
|
|
|
|
|
|
|
|
Quelle sont, après cette étude, les conclusions du conseil génétique que vous pouvez apporter à l'individu III-1?
Quelle précision cette étude apporte-t'elle à la détermination des génotypes des individus III-2 et III-3?
3 Dépistage et diagnostic d'une anomalie chromosomique
La partie obligatoire du programme nous a fourni l'occasion d'étudier des exemples d'anomalies du caryotype portant sur le nombre de chromosomes. Il existe aussi des anomalies portant sur la structure des chromosomes, comme les translocations. Comment des examens cliniques peuvent-ils conduire à leur diagnostic?
L'exemple ci-dessous est donné à titre d'exemple parmi les nombreux cas rencontrés cliniquement.
LA TRISOMIE 21 PAR TRANSLOCATION
Quelques marqueurs: le risque d'une anomalie chromosomique chez un foetus est évalué par différents marqueurs:
une mesure échographique chez le foetus,
des dosages sanguins d'une hormone foetale (HCG) chez la mère,
des dosages sanguins d'une protéine foetale: l'alphafoetoprotéine (AFP) chez la mère. Synthétisée par le foie foetal, elle provient du sérum foetal par filtration rénale. La concentration maximum en AFP dans le liquide amniotique est atteinte à 12 semaines, puis la concentration décroît progressivement
Considérons le cas d'une patiente: Madame X qui consulte un médecin alors qu'elle a eu plusieurs grossesses qui n'ont pas abouti et qu'elle est à nouveau enceinte.
Les examens ci-dessus avaient été pratiqués au cours d'une précédente grossesse qui n'avait, en effet, duré que 17 semaines. Ils sont pratiqués lors de la grossesse en cours. Les résultats avaient été et sont les suivants:
|
MARQUEURS |
VALEURS MESUREES LORS D'UNE PRECEDENTE GROSSESSE |
VALEURS HABITUELLES |
VALEURS MESUREESLORS DE LA GROSSESSE EN COURS | |
|
FOETUS: échographie à la 13e semaine |
EPAISSEUR DU PLI CUTANE DE LA NUQUE |
5 mm |
< 3 mm |
2 mm |
|
MADAME D: dosages sanguins à la 16e semaine |
HORMONE HCG |
80 U / mL |
35 ± 25 U / mL |
29 U / mL |
|
|
PROTEINE AFP |
23,6 U / mL |
33,8 ± 2,7 U / mL |
34 U / mL |
Données statistiques:
|
TAUX D'AVORTEMENTS SPONTANES EN TOUT DEBUT OU EN COURS DE GROSSESSE POUR DIFFERENTES ANOMALIES CHROMOSOMIQUES | |
|
Trisomie 13 |
100 % |
|
Trisomie 14 |
75 à 80 % |
|
100 % | |
|
Monosomie 13 |
100 % |
|
Monosomie 14 |
100 % |
|
Monosomie 21 |
100 % |
Caryotypes des parents (Monsieur et Madame X)
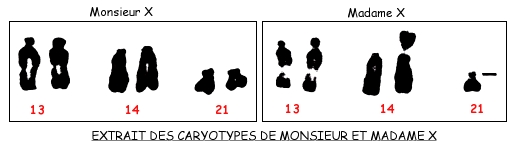
![]() A partir des documents qui précèdent, retrouvez comment le médecin va expliquer à Madame X la cause de ses différents avortements spontanés et expliquez pourquoi il prescrit une amniocentèse afin d'établir le caryotype du nouveau foetus.
A partir des documents qui précèdent, retrouvez comment le médecin va expliquer à Madame X la cause de ses différents avortements spontanés et expliquez pourquoi il prescrit une amniocentèse afin d'établir le caryotype du nouveau foetus.
4 Un enjeu: la thérapie génique somatique
On peut pallier la déficience d'un gène par une thérapie génique somatique.
"La thérapie génique consiste à utiliser un gène comme médicament pour corriger aussi bien des maladies génétiques que des maladies acquises.
Dans le cas des maladies génétiques, cette stratégie thérapeutique consiste à apporter dans la cellule la version « fonctionnelle » du gène défectueux pour pallier sa fonction déficiente.
Dans le cas des maladies acquises (cancers, maladies neurodégénératives, maladies infectieuses), cette stratégie thérapeutique consiste à introduire dans la cellule un gène ayant une fonction thérapeutique : destruction de cellules cancéreuses ou infectées par un virus, maintien en vie de cellules nerveuses..." (INRP).

