TP1 : Préparation d’un indicateur coloré naturel. Le jus de chou rouge
Conditions d’achèvement
TP1 : Préparation d’un indicateur coloré naturel
Le jus de chou rouge
I- Objectifs du TP :
Préparer une solution de jus de chou rouge
Montrer les différentes couleurs de la solution suivant la valeur du pH.
Rappeler la définition d’un indicateur coloré et de sa zone de virage.
II-Préparation :
Couper ¼ de chou rouge frais en petits morceaux (FIG 1)
.
Porter à ébullition environ 500mL d’eau distillée et y introduire les morceaux de chou.
Remuer le mélange avec une spatule, La solution prend une teinte violette caractéristique (FIG 2).
Filtrer la solution et l’introduire dans un flacon (FIG 3).
Après refroidissement fermer le flacon et le stocker dans un réfrigérateur pour conserver la solution.
III- Les différentes teintes de la solution suivant le pH :
Préparons les 5 solutions suivantes de pH approximativement connu (FIG ci-dessous):
1- solution d’acide chlorhydrique (pH=1)
2-vinaigre (pH=3)
3-eau du robinet (pH=7),
4-eau savonneuse (pH=8),
5-solution de soude (pH=13)
Versons dans chaque récipient 5mL de jus de chou rouge précédemment préparé, nous obtenons une échelle de teinte de l’indicateur coloré suivant le pH (FIG ci-dessous)
IV- Comment expliquer la formation des couleurs ?
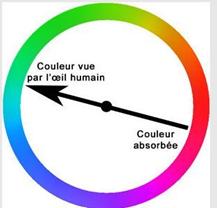
La coloration d’une solution résulte d’une absorption dans le visible des espèces chimiques présentes dans celle-ci.
La couleur vue par l’œil est le complémentaire de la couleur absorbée.
La couleur blanche peut être considérée comme l’addition : Blanc=Bleu+Vert+Rouge
Par exemple, si la solution absorbe dans le rouge, l’œil voit la couleur complémentaire soit le blanc – rouge =bleu/vert.
La couleur bleue résulte d’une absorption dans le jaune
Le diagramme suivant permet de faire correspondre couleur absorbée et couleur vue par l’œil.
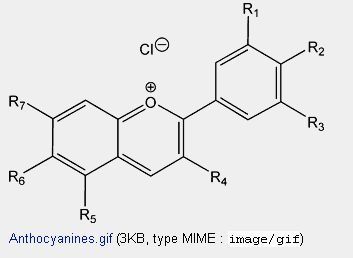
Le jus de chou rouge contient des molécules d’anthocyanine (voir ci-dessous).
L’absorption des couleurs résulte de la présence de liaisons dites conjuguées ( avec alternance … liaison double-liaison simple-liaison double….). ou/ et de cycles benzéniques.
Suivant le pH, les groupements R1, R2…. se modifient ce qui entraine des modifications de la longueur d’onde d’absorption.
V-Définition d’un indicateur coloré :
C’est un couple acide/base dont les deux espèces conjuguées (appelons les HInd/Ind-) colorent la solution avec des teintes différentes. (Par ex : HInd colore en rouge et Ind- colore en bleu) .
Cela signifie que Hind et Ind- possèdent des spectres d’absorption différents dans le visible.
Un indicateur coloré est caractérisé par sa zone de virage (appelée aussi « teinte sensible ») .
Soit pKAi la constante du couple de l’indicateur.
La zone de virage de l’indicateur est définie arbitrairement comme étant l’ensemble des valeurs du pH comprise entre pKAi -1 et pKAi +1.
Rappelons la relation entre le pH et le pKAi
Trois cas peuvent se produire suivant les valeurs du pH :
1- pH<pKAi -1 :
La relation précédente entraine : [HInd]>10.[Ind-]
L’espèce Hind est alors très majoritaire et impose sa couleur à la solution.
2- pH>pKAi +1 :
On a cette fois: 10.[Ind-]>10.[HInd] ;
Dans ce cas, la forme Ind- trés majoritaire impose alors sa couleur à la solution.
3- pKAi -1 <pH< pKAi +1 :
Les deux espèces du couple ont des concentrations assez voisines, la couleur résulte de l’absorption de la lumière par les deux espèces .On obtient alors un mélange des deux couleurs.
Un indicateur est en général utilisable dans un domaine de pH limité
Le chou rouge est un mélange de plusieurs couples absorbant dans le visible. Cela permet d’obtenir une plus grande variété de couleurs différentes dans un domaine de pH plus étendu.
On peut qualifier cet indicateur d’universel.
Modifié le: jeudi 4 août 2016, 15:26