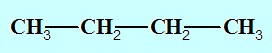Exercices corrigés sur la quantité de matière (partie2)
RECUEIL D’EXERCICES CORRIGES (partie 2)
Auteur : Guy Chaumeton http://pagesperso-orange.fr/guy.chaumeton/2d07chc.htm
Exercice 1

Correction :
|
Propane gazeux |
Masse molaire (g / mol) |
|
|
V A = 0,80 L |
m A = 1,41 g |
M A = 44,0 |
|
|
|
|
1. Quantité de matière n A de propane contenu dans le flacon.
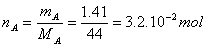
2. Volume molaire V m du gaz dans les conditions de l’expérience.
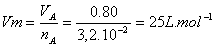
3-Masse molaire MB :
Dans les mêmes conditions , un volume double de gaz contient une quantité de matière double indépendante de la nature du gaz l(loi d’Avogadro sur les gaz).
Ainsi VB=2VA alors nB=2nA=6,4.10-2mol.
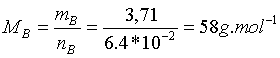
4-Formule brute :
Le corps pur B de formule CxH2x+2 a pour masse molaire :
MB=(2x+2)MH+xMc=(2x+2)*1+x*12=58g.mol-1.
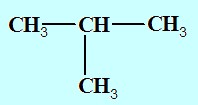
On en déduit x=4 ,la formule brute est donc: C4H10. C’est un alcane.
5- Différents isomères :
|
Formules semi-développées et topologiques |
Chaînes carbonées principale |
|
Butane
|
4 C |
|
2-méthylpropane ou isobutane
|
3 C |
Exercice 2

Correction
a)- Masse molaire de l’acide ascorbique :
- M ( C6H8O6) = 6 M (C) + 8 M (H) + 6 M (O)
- M ( C6H8O6) » 2 x 12,0 + 8 x 1,01 + 6 x 16,0
- M ( C6H8O6) » 176 g . mol -1.
b) - quantité de matière d’acide ascorbique dans un comprimé :
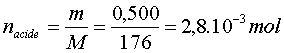
c)- Nombre de molécules d’acide ascorbique :
- N = n . N A
- N = 2,8 x 10 – 3 x 6,02 x 10 23
- N » 1,7 x 10 21 molécules
d)- pourcentages en nombre d’atomes
|
|
Total |
Carbone |
Hydrogène |
oxygène |
|
Nombre d’atomes |
20 |
6 |
8 |
6 |
|
pourcentage |
100 % |
30 % |
40 % |
30 % |
e)- Pourcentage massique :
|
|
Total |
Carbone |
Hydrogène |
oxygène |
|
Masse molaire |
176 |
6 x 12,0 |
8 x 1,0 |
6 x 16,0 |
|
pourcentage |
100 % |
40,9 |
4,5 |
54,5 |
Exercice 3

a)- quantité de matière de dihydrogène contient le flacon :
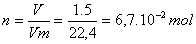
b)- masse de dihydrogène contient le flacon :
MH=1,01g.mol-1.
- m = n (H 2) . M (H 2) = 6,7 x 10 – 2 x 2 x 1,01 =1,3.10-1g
c)- Quantité de matière de dihydrogène :
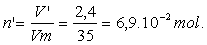
d)- Comparaison et explication.
: La quantité et donc la masse de gaz dans 1,5 L à 0 ° C est voisine de celle dans 2,4 L à 150 ° C à la même pression.
- Lorsque l’on chauffe un gaz, la pression restant la même, sa masse volumique diminue, il se dilate.