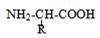La constitution chimique de la matière vivante
Méthodes analytiques de détermination de la constitution chimique de la matière vivante.
1- Analyses quantitatives
a) Expérience de déshydratation

- Peser 100g de salade fraîche avec une balance de précision : masse fraîche
- Placer la, 48heures dans une étuve à 60°C
- Peser de nouveau: masse sèche
- En effectuant une simple soustraction, on peut calculer la quantité d’eau.
Quantité d’eau = masse fraîche - masse sèche
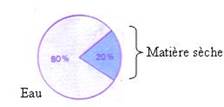
Résultat
L’expérience montre que la quantité d’eau est largement supérieure à la quantité de matière sèche dans une matière vivante
b) Expérience de la calcination de la matière sèche

La calcination de la matière révèle la présence de :
- Substances carbonées combustibles : substances organiques représentant 95%
- Substances minérales incombustibles à l’origine des cendres représentant 5%
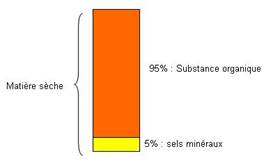
Ces analyses quantitatives montrent l’inégale abondance de ces divers constituants de la matière vivante
2 – Analyses qualitatives
Des méthodes plus complexes permettent de connaître avec précision la composition chimique de la matière chimiques du monde vivant.
a) Substances organiques
Les substances organiques se divisent en trois grands groupes : Les glucides, les lipides et les protides.
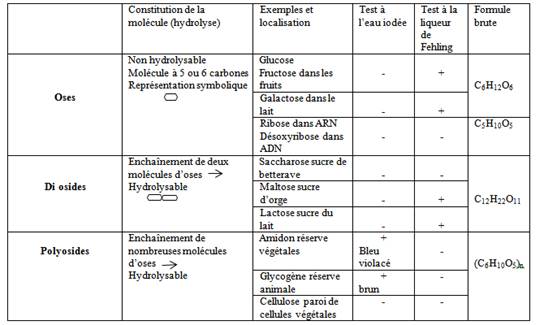
Les glucides : constitués de trois éléments chimiques principaux C, H et O. Ils comprennent les sucres (glucose, fructose, lactose….) l’amidon, la cellulose et le glycogène.
- Des réactifs spécifiques sont utilisés pour identifier ces substances dans la matière vivante.
· Réduction de la liqueur de Fehling par le glucose.
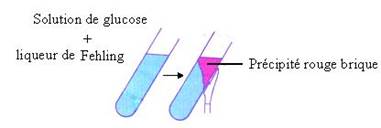
On dit que le glucose réduit la liqueur de Fehling.
Réaction de caractérisation de l’amidon et du glycogène utilisant le réactif eau iodée
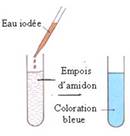
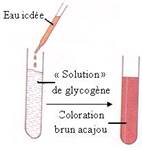
- Les principaux glucides
Les lipides : constitués également de C, H et O. Ce sont les constituants des corps gras, corps onctueux, insolubles dans l’eau. Ils laissent une tache translucide indélébile sur le papier.
Un lipide est un ester c’est-à-dire un corps chimique formé par la combinaison d’acide et d’alcool.
Les acides constitutifs sont les acides gras(chaînes hydrogéno-carbonées terminées par une fonction acide carboxylique). Si la chaîne hydrogéno-carbonée contient une ou plusieurs doubles liaisons, l’acide gras est insaturé (acide oléique, linoléique et érucique); s’il n’y a pas de doubles liaisons, l’acide gras est saturé (acide butyrique, stérique, et palmitique)
L’alcool le plus fréquent est le trialcool, le glycérol (CH2OH-CHOH- CH2OH)
Les glycérides sont les lipides les plus communs, estérification du glycérol par une, deux ou trois molécules d’acides gras
Exemple la trioléine glycérol estérifiée par trois molécules d’acides oléiques représentée par le schéma suivant
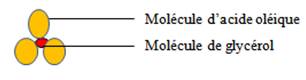
Certains lipides libèrent, par hydrolyse, non seulement de l’alcool et des acides, mais également d’autres molécules : ce sont des lipides complexes
Les protides : constitués de quatre éléments chimiques principaux : C, H, O et N. Le soufre S et le phosphore P sont le plus souvent présents dans les molécules de protide. Ils comprennent des molécules plus simples : les acides aminés et des molécules plus complexes : les peptides et les protéines.
Deux types de réaction chimique permettent de mettre en évidence les molécules de peptides et protéines. (1)
Réaction xanthoprotéique utilisant de l’acide nitrique, puis après rinçage à l’eau, de l’ammoniaque comme réactifs spécifiques (2) et (3) (Coloration jaune serin puis teinte orangée)
Réaction de biuret utilisant le sulfate de cuivre, après rinçage à l’eau, de la soude ou de la potasse (4) et (5) (teinte violette très intense)
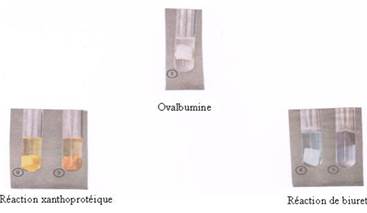
Principaux protides
|
Différents protides |
Constitution de la molécule |
Exemples |
|
Acides aminés Réactions caractéristiques négatives Formule générale :
|
- Protides élémentaires de faible masse moléculaire - Chaque acide aminé est caractérisé par : . une fonction amine –NH2 . une fonction carboxyle –COOH . Un radical –R variable
|
Il existe 20 acides aminés dans la matière vivante : Acide aspartique, acide glutamique, alanine, arginine, asparagine, cystéine, glutamine, glycine, histidine, isoleucine, leucine, lysine, méthionine, phénylalanine, proline, sérine, thréonine, tryptophane, tyrosine et valine. |
|
Peptides Réactions caractéristiques positives |
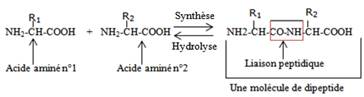
Polymères formés d’un enchaînement d’acides aminés liés par des liaisons peptidiques : oligopeptides, polypeptides(ou holoprotéines) selon le nombre n d’acides aminés enchaînés |
- Chaînes courtes n<10 ex : pénicilline - Chaînes moyennes 10 < n < 100 ex : hormone hypophysaire prolactine - chaines longues n 100 ex : globuline, LH et FSH |
|
Hétéroprotéines
|
Molécules formées d’un enchaînement d’acides aminés portant des groupements non protidiques de nature diverse |
- Hémoglobine : 4 molécules de globine chacune associée à un hème (molécule contenant de fer) - glycoprotéine : protéine + glucide
|
Holoprotéine = polypeptides formées uniquement d’acides aminés
Hétéroprotéine = polypeptides formées d’acides aminés et d’autres groupement non protidiques
Protéine = grosse molécule polypeptidique
Enchaînement de deux acides aminés
b) Substances minérales
L’eau : Expérience de mise en évidence de l’eau dans la matière vivante.
| Les gouttelettes d'eau sur les paroi du tube montrent la présence de l'eau dans la matière vivante |
Les sels minéraux :
Ajouter un litre d’eau distillée dans les cendres après calcination d’une matière vivante (exemple : salade)
Porter à l’ébullition pendant une quinzaine de minutes, puis filtrer .Le filtrat obtenu est reparti dans plusieurs tubes à essai. Des réactifs spécifiques sont ajoutés dans chacun de tubes pour mettre en évidence les sels minéraux correspondants ;
Le tableau suivant résume les résultats :
|
Réactifs ajoutés au filtrat |
Réactions obtenues |
Sels minéraux mis en évidence |
|
Solution de Nitrate d’argent |
Précipité blanc de chlorure d’argent qui noircit à la lumière. |
Chlorures |
|
Solution de chlorure de baryum |
Précipité blanc de sulfate de baryum |
Sulfates |
|
Réactif ammoniaco-magnésien ou Solution nitromolybdique d’ammonium |
Précipité blanc de phosphate ammoniaco-magnésien Ou précipité jaune serin |
Phosphates PO3-4 |
|
Acide picrique à saturation |
Précipité en aiguilles jaunes de picrate de potassium |
Sels de potassium |
|
Solution d’oxalate d’ammonium |
Précipité blanc d’oxalate de calcium |
Sels de calcium : Ca2+ |
|
Solutions d’acide chlorhydrique |
Effervescence avec dégagement de CO2 |
Carbonates |
|
Diphénylamine ou Cuivre et acide sulfurique |
Coloration bleue ou dégagement de dioxyde d'azote, gaz roux |
Nitrates |
|
Solutions de ferrocyanure de potassium |
Précipité bleu |
Sels de fer |
|
Passage à la flamme |
La flamme prend une coloration jaune orangé. |
Ion sodium Na+ |
3- Exemple de composition en éléments chimiques de la matière vivante en pourcentage
|
Elément |
Pourcentage |
|
|
Carbone C Hydrogène H Oxygène O Azote N Phosphate P Soufre S Calcium Ca Sodium Na Potassium K |
19,37 9,31 62,81 5,14 0,63 0,64 1,38 0,26 0,22 |
Macroéléments |
|
Magnésium Mg Aluminium Al Silicium Si Fer Fe |
0,04 0,0001 0,004 0,005 |
Oligo-éléments |
L’expérience montre que la quantité d’eau est largement supérieure à la quantité de matière sèche dans une matière vivante