Du génotype au phénotype
DU GÉNOTYPE AU PHÉNOTYPE
Le phénotype est l'ensemble des caractères observables (morphologiques, physiologiques, biochimiques) d'un individu
Nous envisagerons les relations entre l'information génétique et les conséquences phénotypiques de son expression.
Eléments requis:
- notions de phénotype et de caractère,
- signification d'un acide aminé dans une protéine,
- comprendre une expérience de digestion in vitro en analysant les produits obtenus par un réactif (lugol, liqueur de Fehling),
- connaître la structure de la molécule d'ADN et sa signification dans la cellule.
Thèmes traités et activités pédagogiques (durée: 6 semaines):![]() Phénotype et protéines
Phénotype et protéines![]() Synthèse des protéines
Synthèse des protéines![]() Gènes, phénotypes et environnement
Gènes, phénotypes et environnement
Thème 1: Phénotype et protéines
1.1 LA REALISATION DU PHENOTYPE
1.1.1 Les échelles d'observation du phénotype: la sicklémie
- l'organisme: dans la sicklémie ou drépanocytose, maladie héréditaire du sang, rien ne distingue extérieurement un individu sain d'un malade: ce dernier présente une anémie chronique, des crises de douleurs articulaires (la radiographie révèle des nécroses osseuses et cartilagineuses); la mortalité est élevée.
- la cellule: au niveau cellulaire, les hématies ont une forme de faucille chez les malades lorsque la pression en dioxygène est faible, une forme de disque biconcave chez les sujets sains.
Observé au microscope électronique, le globule rouge drépanocytaire désoxygéné apparaît rempli d'un gel formé par des cristaux allongés longs de 1 à 15 µm constitués par des polymères d'hémoglobine: déformé par ces structures fibreuses tubulaires, il prend une forme caractéristique en faucille.
- la molécule: l'hémoglobine est une protéine du cytoplasme des hématies. Elle est constituée de quatre chaînes polypeptidiques identiques deux à deux: deux chaînes ![]() et deux chaînes
et deux chaînes ![]() .
.
![]()
![]() Vous allez utiliser le logiciel ANAGENE:
Vous allez utiliser le logiciel ANAGENE:
(version de démonstration: http://www.cndp.fr/svt/anagene/telechargement.htm)
1 - Ouvrez le logiciel ANAGENE et choisissez dans "Thèmes d'étude": "RELATIONS GENOTYPE-PHENOTYPE".
2- Choisissez "Phénotype drépanocytaire". Les séquences nucléiques et protéiques s'affichent. Sélectionnez, à gauche, HbS protéique et HbA protéique: cette dernière sera prise comme référence (![]() ).
).
3 - Comparez les séquences de la protéine normale HbA et de la protéine des malades HbS (il s'agit des chaînes ![]() ), en optant pour "alignement avec discontinuité" dans la fenêtre de dialogue.
), en optant pour "alignement avec discontinuité" dans la fenêtre de dialogue.
4 - Faites apparaître les identités * et la (ou les) différence(s).
5 - Dites par quoi la molécule d'hémoglobine des malades (HbS) se distingue de l'hémoglobine normale (HbA).
Ces trois niveaux du phénotype (organisme, cellule, molécule) découlent les uns des autres:
polymérisation moléculaire => fibres déformant les globules => fragilisation et destruction de ceux-ci, provoquant l'anémie.
1.1.2 Les protéines-enzymes:
la réalisation du phénotype dépend étroitement de l'intervention des protéines. Une protéine est une molécule réalisant une fonction biologique donnée.
Exemples:
- hémoglobine et transport des gaz respiratoires,
- myosine et actine interviennent dans la contraction musculaire.
Parmi ces protéines, certaines, les enzymes jouent un rôle important: nous prendrons l'exemple de la synthèse de la mélanine, pigment donnant sa couleur à la peau.
Pour illustrer ce fait, à défaut de faire l'observation directement au microscope, vous pourrez consulter le portail du Département d'Histologie et d'embryologie de la faculté Universitaire FUNDP de NAMUR. Choisissez la rubrique "Histologie spéciale humaine - Système cutané - Epiderme".
![]()
![]() Observation microscopique de coupe de peau humaine
Observation microscopique de coupe de peau humaine
Après avoir observé ...
- au faible grossissement, les mélanocytes des couches profondes de l'épiderme,
- à un plus fort grossissement, au microscope électronique les mélanosomes cytoplasmiques,
vous rendrez compte de vos observations par deux dessins. Vous utiliserez les explications fournies pour faire apparaître, dans vos annotations, le devenir des grains de mélanine dans la peau.
La voie de biosynthèse de la mélanine est connue: elle débute par l'intervention d'un précurseur, un acide aminé, la L-tyrosine, et comprend six étapes:
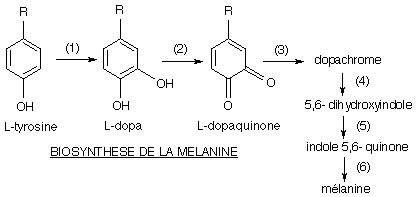
Les deux premières étapes (1) et (2) sont catalysées par une même enzyme: la tyrosinase. C'est le défaut d'activité de cette enzyme qui est responsable de l'absence de mélanine, donc de l'albinisme (phénotype se caractérisant notamment par l'absence de coloration au niveau de la peau). Ainsi les molécules protéiques que sont les enzymes, par leur présence ou leur absence, interviennent dans la réalisation du phénotype.
Une protéine est constituée d'un enchaînement d'acides aminés: il en existe 20 naturels. Le nombre d'acides aminés constitutifs variant d'une protéine à l'autre, les protéines se caractérisent donc par leur extrême diversité (un enchaînement de n acides aminés offre 20en séquences différentes).
La diversité des protéines est donc à l'origine de la variabilité des caractères phénotypiques. Il en est de même pour les phénotypes alternatifs d'un même caractère.
1.2 LES ENZYMES, DES PROTEINES ESSENTIELLES
![]()
![]() Etude expérimentale de l'hydrolyse enzymatique du saccharose
Etude expérimentale de l'hydrolyse enzymatique du saccharose
Après avoir observé des cellules de levure de boulanger (Saccharomyces cerevisiæ) au microscope à partir d'une culture bien oxygénée (10g de levures dans 100 mL d'eau, soit 10%) et réalisé une solution de saccharose à 3%, vous répartirez dans 5 tubes à essais placés au bain-marie à 30°C:
- tube 1: 2mL de solution saccharosée
- tube 2: 2 mL de culture de levure
- tube 3: 2mL de solution saccharosée + 2 mL de culture de levure
- tube 4: 2mL de solution saccharosée + 2 mL de filtrat de culture de levure
- tube 5: 2mL de solution saccharosée + 2 mL de culture de levure (portés au préalable à ébullition puis refroidis)
Suivez la réaction d'hydrolyse à l'aide d'un glucomètre. Interprétez. Comparez cette hydrolyse enzymatique avec l'hydrolyse chimique.
Voyez l'animation concernant l'hydrolyse du saccharose.
1.2.1 La catalyse enzymatique:
<>- les enzymes sont des biocatalyseurs,
- les enzymes agissent à faible concentration,
- la vitesse d'une réaction enzymatique est élevée (~1000 molécules de substrat / seconde),
- les enzymes agissent dans les conditions biologiques (température et pression compatibles avec la vie).
1.2.2 Spécificités enzymatiques de substrat et d'action
- une enzyme donnée n'agit que sur un seul substrat (son nom indique la nature du substrat sur lequel elle agit): ainsi une saccharase hydrolyse le saccharose, une amylase, l'amidon, ...
N.B. sur un substrat, plusieurs enzymes peuvent agir, mais la reconnaissance se fait sur une partie différente de la molécule.
- sur un substrat, une enzyme catalyse un seul type de réaction: ainsi la tyrosine-hydrolase transforme la tyrosine en L-dopa, la tyrosine-kinase en tyrosine-phosphate, ...
1.2.3 Le complexe enzyme-substrat: un exemple, la carboxy-peptidase, une enzyme synthétisée par le pancréas et déversée dans l'intestin grêle,
Sur le site ci-dessous vous sélectionnerez l'étude intitulée: "Structure-fonction d'un complexe enzyme-substrat, la carboxypeptidase" :
http://www.inrp.fr/Acces/Biogeo/model3d/chimespt.htm
![]()
![]() Vous réaliserez l'étude proposée qui concerne:
Vous réaliserez l'étude proposée qui concerne:
la structure de la carboxypeptidase, enzyme digestive qui hydrolyse l'extrémité carboxyl-terminal dans une chaîne polypeptidique:
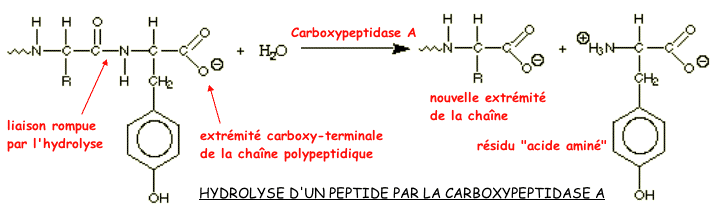
la localisation du site catalytique de l'enzyme,
la formation du complexe enzyme-substrat,
la catalyse enzymatique proprement dite.
La catalyse enzymatique nécessite la fixation temporaire de l'enzyme sur le substrat (complexe E-S) par l'intermédiaire du site actif de l'enzyme:
Enzyme + Substrat -> E-S -> E + Produits
L'activité enzymatique s'évalue en mesurant la vitesse de la réaction catalysée (quantité de substrat transformé ou quantité de produits formés).
Le suivi d'une réaction enzymatique par colorimétrie:
Il est possible de suivre la façon dont une réaction enzymatique se déroule en utilisant la technique d'ExAO. Le capteur utilisé dépend de la réaction étudiée. Dans l'exemple ci-dessous nous utilisons un luxmètre et le dispositif confectionné permet de faire une mesure colorimétrique de la réaction enzymatique d'hydrolyse de l'amidon.
Principe de la mesure colorimétrique: on colore initialement la solution colloïdale d'empois d'amidon (substrat S) par le Lugol (réactif) en bleu. En introduisant au temps t = O la solution enzymatique (E), la réaction se traduit par la diminution de la concentration en substrat, donc par la décoloration de la solution: d'abord en rouge vineux témoignant de l'appariton de dextrines, puis en orangé-jaune (couleur du Lugol) correspondant à la disparition totale de l'amidon et à l'apparition de maltose et d'un peu de glucose (produits P).
C'est la variation de la quantité de lumière absorbée par le milieu (absorbance) qui est la variable permettant de suivre la réaction: elle est mesurée par le luxmètre qui détermine le % de lumière traversant l'enceinte transparente, par rapport à la quantité de lumière maximale fournie par la lampe.
L'usage d'une lampe à lumière froide évite d'introduire un autre paramètre variable par échauffement du milieu réactionnel.
Les mesures se font sur un temps court et la vitesse de la réaction est déterminée en début de réaction (vitesse initiale Vo) de manière à prendre en compte la vitesse maximale de la réaction (Vmax).
![]()

![]() Cinétique enzymatique par ExAO (une amylase)
Cinétique enzymatique par ExAO (une amylase)
Matériel: empois d'amidon à 1‰ ou g/L (1g d'amidon pour 1000g d'eau portée à 80°C) dans un tampon pH7, Lugol, bain-marie thermostaté, pipettes, maxilase du commerce (1 comprimé écrasé et dissous dans 100mL d'eau).
Dispositif expérimental: cliquez sur le schéma ci-dessous pour visualiser la photographie du montage.
Protocole:
Dans le tube de verre, mettez 50mL d'empois d'amidon conservé au bain-marie à la température de 30°C et 1 goutte de Lugol afin d'obtenir une belle coloration bleue. Ajustez la lampe et la sonde luxmétrique. a chaque renouvellement, veillez à mettre les mêmes quantités de ces deux produits: la concentration en substrat [S] et en réactif reste constante.
Après avoir préparé une solution de maxilase, introduisez à l'aide de la seringue un petit volume (1 mL) de cette solution enzymatique en même temps que vous lancez la mesure dans le logiciel d'ExAO.
Recommencez l'opération en utilisant des volumes croissants de solution enzymatique (2, 3, 5, 10 mL): vous faites ainsi varier la concentration en enzyme [E].
Superposez les courbes de cinétique et à chaque fois faites calculer au logiciel la pente de la courbe à l'origine (a), qui est proportionnelle à la vitesse initiale (Vi) de la réaction enzymatique.
Expression des résultats:
Notez dans un tableau à double entrée [E] et Vi. Construisez la courbe représentative de la fonction Vi = f([E]).
Interprétez ces résultats.
1.3 FORME ET ACTIVITE D'UNE ENZYME
1.3.1 Forme stéréochimique d'une enzyme
Nous retiendrons de l'étude intitulée: "Structure-fonction d'un complexe enzyme-substrat, la carboxypeptidase" du §1.2.3 que:
- la structure primaire (linéaire) de la protéine-enzyme est déterminée par l'enchaînement par liaisons peptidiques des acides aminés constitutifs.
- la structure secondaire (spatiale) est réalisée par les liaisons hydrogène, les liaisons ioniques, les ponts disulfure, entre acides aminés. Celle-ci peut être modélisée par traitement informatique.
Par ailleurs:
- la biologie moléculaire permet, par mutagenèse, de modifier certains acides aminés proches du site actif, pour inhiber ou augmenter la capacité catalytique d'une enzyme.
1.3.2 Conditions du milieu et catalyse enzymatique
- le pH: chaque enzyme possède un pH pour lequel son activité est optimale.
De part et d'autre du pH optimum, le changement d'ionisation des acides aminés du site actif, modifie le fonctionnement de celui-ci. Pour des valeurs plus éloignées, les chaînes latérales sont modifiées: l'enzyme perd sa forme et devient inactive.
- la température accélère la vitesse de la réaction et agit sur la configuration spatiale de l'enzyme.
De part et d'autre de la température optimale, l'enzyme est dénaturée pour des températures hautes, inactivée de manière réversible pour des températures basses.
Certains micro-organismes présentent des enzymes actives aux températures extrèmes.
![]()
![]()
![]() Etude d'un facteur d'influence de la réaction enzymatique: la température
Etude d'un facteur d'influence de la réaction enzymatique: la température
Matériel: empois d'amidon à 0,05% dans un tampon pH7, Lugol, bain-marie thermostaté, pipettes 10mL et 1mL, maxilase du commerce (sirop ou comprimés), plateau de coloration à puits de 1mL.
 Protocole:
Protocole:
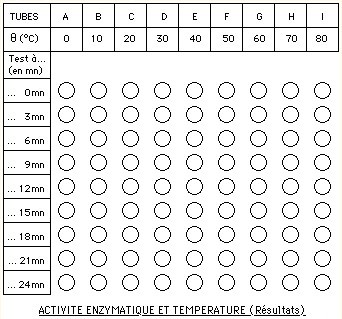
On remplit 9 tubes à essais (A, B, C, ... I) de 15mL d'empois d'amidon à 0,05%, que l'on place chacun au bain-marie à 0°, 10°, 20°, ... 80°C.
De la maxilase (amylase du commerce) est diluée à raison d'un comprimé dans 100mL d'eau. 1mL de cette solution enzymatique, préalablement porté à la température du bain, est versé dans chacun des tubes A, B, C ... I.
Une étude de la vitesse de la réaction enzymatique en fonction de la température est menée en prélevant toutes les 3 minutes 0,7mL du contenu des tubes que l'on place dans l'un des compartiments d'un plateau de coloration avec à chaque fois une goutte de Lugol et on homogénéise.
Expression des résultats:
Notez pour chaque mesure les résultats obtenus en colorant les pastilles de couleur dans le schéma ci-contre que vous imprimerez: vous obtenez une représentation graphique de la vitesse de la réaction enzymatique en fonction de la température.
Interprétez-la en la mettant en relation avec la nature protéique des enzymes, dont la structure, et donc la fonction, sont sensibles aux variations de température.
Thème 2: Synthèse des protéines
2.1 UNE EXPRESSION DE L'INFORMATION GENETIQUE EN DEUX ETAPES
2.1.1 Transcription et traduction
Les protéines sont synthétisées à partir des acides aminés issus de la digestion, mais c'est l'information génétique qui impose la séquence de ceux-ci.
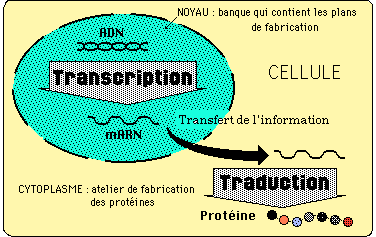 Chez les eucaryotes, le noyau, par l'intermédiaire des chromosomes, détient l'intégralité de l'information génétique de l'organisme: chaque molécule d'ADN est le support de nombreux gènes, mais toutes les cellules n'expriment pas les mêmes gènes (différenciation).
Chez les eucaryotes, le noyau, par l'intermédiaire des chromosomes, détient l'intégralité de l'information génétique de l'organisme: chaque molécule d'ADN est le support de nombreux gènes, mais toutes les cellules n'expriment pas les mêmes gènes (différenciation).
Lors de la transcription, des copies d'ADN, sous forme d'ARN, quittent le noyau par les pores de sa membrane (ARNm ou ARN messagers).
Dans le cytoplasme a lieu la traduction: les acides aminés sont assemblés en chaînes polypeptidiques selon la séquence imposée par le code détenu par l'ARNm.
2.1.2 L'ARN messager
![]()
![]() Vous ferez une étude comparative de la molécule d'ADN et de celle d'ARN avec le logiciel Rasmol:
Vous ferez une étude comparative de la molécule d'ADN et de celle d'ARN avec le logiciel Rasmol:
1) téléchargement de Rasmol:
http://www.inrp.fr/Acces/Biogeo/model3d/data3d.htm
2) thème d'étude: "Structure de l'ADN et de l'ARN (Librairie de nucléotides associée)"
http://www.inrp.fr/Acces/Biogeo/model3d/data3d.htm
L'ARN messager (ARNm) est une molécule qui sert d'intermédiaire entre le noyau et le cytoplasme. Elle est comparable à l'ADN avec quelques différences:
- le sucre est du ribose (C5H10O5),
- la base azotée thymine (T) est remplacée par l'uracile (U),
- la molécule n'est formée que d'une seule chaîne de nucléotides,
- la longueur de la molécule est nettement plus faible que celle de l'ADN, car elle n'en représente que la copie d'un seul gène ( masse molaire: entre 25 000 et 500 000).
- la durée de vie de l'ARN est très courte (quelques minutes à quelques dizaines de minutes).
2.2 LE CODE GENETIQUE
2.2.1 Gène et polypeptides, deux molécules séquencées
![]()
![]() Le logiciel ANAGENE va nous permettre d'analyser un fragment de séquence d'ADN et d'ARNm correspondant.
Le logiciel ANAGENE va nous permettre d'analyser un fragment de séquence d'ADN et d'ARNm correspondant.
(version de démonstration: http://www.cndp.fr/svt/anagene/telechargement.htm)
1) Ouvrez ANAGENE et choisir dans "Thèmes d'étude": "Expression de l'information génétique".
2) Choisissez "Globine ß". Les séquences nucléotidiques suivantes s'affichent:
- ADN ß brin 1
- ADN ß brin 2
- ARN m
3) Retrouvez la complémentarité des nucléotides de l'ADN: définissez-la.
4) Quel commentaire vous sugère la comparaison de la séquence de l'ARNm avec le brin 1 de l'ADN, d'une part, avec le brin 2 de l'ADN, d'autre part?
Le brin 1 sera appelé brin codant, le brin 2 brin transcrit. Le passage ADN ---> ARNm est appelé transcription.
Un gène (ADN) ou sa copie (ARNm) est une séquence de nucléotides qui gouverne la synthèse d'un polypeptide: ce dernier est une séquence d'acides aminés.
Il existe ainsi une correspondance entre gène et protéine.
2.2.2 La correspondance nucléotides-acide aminé
Vingt types d'acides aminés différents entrent dans la composition des chaînes polypeptidiques, tandis que quatre types de nucléotides constituent celles d'ADN ou d'ARN.
Des expériences ont montré la correspondance entre un triplet de nucléotides ou codon et un acide aminé.
![]()
![]() Continuez le travail commencé dans le §2.2.1.
Continuez le travail commencé dans le §2.2.1.
5) Vous allez traduire le brin d'ARNm en séquence polypeptidique en sélectionant la ligne ARNm et en cliquant sur le bouton  "convertir les séquences" .
"convertir les séquences" .
Le passage ARNm ---> polypeptide ou protéine est appelé traduction.
2.2.3 Un système universel, preuve d'une origine commune des êtres vivants
Il existe mathématiquement 64 triplets de nucléotides différents: le code génétique est donc redondant (maints triplets désignent le même acide aminé), mais univoque (à un triplet, un acide aminé).
L'universalité du code génétique est riche d'applications.

 2.3 MECANISMES DE LA SYNTHESE PROTEIQUE
2.3 MECANISMES DE LA SYNTHESE PROTEIQUE
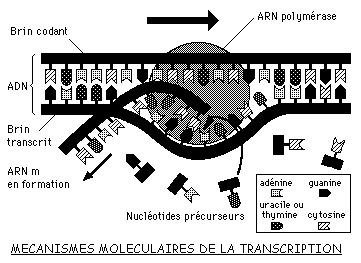
2.3.1 La transcription du gène sous forme d'ARN messager
La transcription nucléaire consiste à "copier" une portion d'ADN en une information identique sous forme d'ARNm.
Cette opération s'effectue dans le noyau:
- ouverture et déroulement d'une portion de la double hélice
- synthèse d'un brin d'ARNm à partir du brin transcrit de l'ADN, grâce à un complexe enzymatique: l'ARN-polymérase, qui incorpore des nucléotides par complémentarité A-U, C-G, T-A, G-C. Plusieurs ARN-polymérases se succèdent le long de l'ARNm, engendrant une amplification de la transcription. Des signaux existent sur l'ADN, qui assurent une régulation de l'expression des gènes.
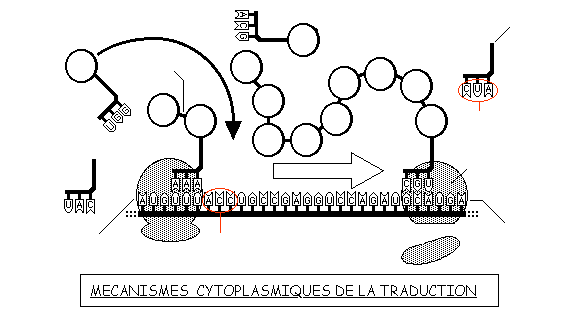
2.3.2 La traduction de l'ARN messager en polypeptide
La traduction cytoplasmique consiste à assembler des acides aminés en chaîne polypeptidique d'après la séquence de l'ARNm.
Ce sont les ribosomes qui assurent cet assemblage en trois temps:
- l'initiation, c'est-à-dire la fixation d'un ribosome sur un triplet de l'ARNm, toujours le même: AUG (codon initiateur),
- l'élongation du polypeptide, par déplacement du ribosome et de l'ARNm, en établissant une liaison peptidique entre le nouvel acide aminé et le précédent, grâce à une enzyme, un ARN de transfert (ARNt) qui apporte un nouvel acide aminé et de l'énergie.
- la terminaison est provoquée par un "codon-stop" de l'ARNm qui fixe le ribosome, libérant la chaîne polypeptidique.
Plusieurs ribosomes se succèdent sur l'ARNm en formant un polysome: chaque molécule d'ARNm gouverne ainsi la synthèse de 10 à 20 molécules polypeptidiques assurant une amplification du phénomène.
Utilisées dans la cellule ou exportées après une maturation dans l'appareil de Golgi, les protéines participent à la réalisation du phénotype.
![]()
![]() Utilisez les renseignements fournis pour annoter le schéma ci-dessus et le code génétique pour trouver la séquence de la chaîne polypeptidique synthétisée.
Utilisez les renseignements fournis pour annoter le schéma ci-dessus et le code génétique pour trouver la séquence de la chaîne polypeptidique synthétisée.
Pour clore l'étude et vous mettre en mémoire de façon visuelle les mécanismes de la synthèse protéique, vous regarderez les animations suivantes sur le site BIOMULTIMEDIA:
Thème 3: Gènes, phénotypes et environnement
3.1 LES PHENOTYPES MULTIGENIQUES
3.1.1 Plusieurs gènes pour un caractère
Certains caractères sont monogéniques: ils ne dépendent que d'un seul gène. Connus par l'étude de certaines maladies génétiques (mucoviscidose, myopathie de Duchenne, ...), ils se traduisent par l'absence ou le dysfonctionnement de la protéine correspondante, mais ces maladies sont rares.
La plupart des caractères dérogent à la règle "un gène -> un caractère": ils dépendent de plusieurs gènes et sont qualifiés de multi- ou polygéniques.
Exemple: la mélanogénèse (synthèse de mélanine) est une voie métabolique qui implique plusieurs gènes codant chacun pour une enzyme d'une étape de réactions successives.
![]()
![]() Avec le logiciel ANAGENE, nous allons proposer une explication au phénotype "albinos".
Avec le logiciel ANAGENE, nous allons proposer une explication au phénotype "albinos".
 1) Ouvrez ANAGENE et choisir dans "Thèmes d'étude": "GENOTYPES ET PREVISIONS EN GENETIQUE HUMAINE - L'albinisme - Allèles du gène de la tyrosinase".
1) Ouvrez ANAGENE et choisir dans "Thèmes d'étude": "GENOTYPES ET PREVISIONS EN GENETIQUE HUMAINE - L'albinisme - Allèles du gène de la tyrosinase".
Vous voyez apparaître les séquences d'un certain nombre d'allèles du gène de la tyrosinase.
2) Vous allez comparer les allèles "Tyrcod1" et "Tyrcod2", qui sont des allèles normaux (Tyrcod1 servira de référence ![]() ).
).
3 - Comparez les séquences nucléotidiques en optant pour "alignement avec discontinuité" dans la fenêtre de dialogue.
4 - Faites apparaître les identités * et la (ou les) différence(s). Exprimez-les.
5 - Convertissez les séquences nucléotidiques en séquences peptidiques (bouton  ): quelle(s) différence(s) constatez-vous?
): quelle(s) différence(s) constatez-vous?
6 - Recommencez l'opération avec un autre allèle (Tyralba1 par exemple) qui détermine une enzyme inactive, donc l'albinisme, comme Tyralba2, Tyralba3, ....
L'établissement d'un caractère phénotypique peut être encore plus complexe. La coloration de la peau nécessite, outre la mélanine, l'exportation de celle-ci des mélanocytes vers les kératinocytes, par des vésicules exigeant une protéine particulière, la myosine, exprimée par un autre gène.
Ainsi, bien que la mélanine puisse être synthétisée, l'absence de myosine, qui normalement est à l'origine de mouvements intracellulaires, empêche la migration de ce pigment des mélanocytes vers les kératinocytes.
3.1.2 Plusieurs génotypes possibles pour un phénotype
Dans le cas des caractères polygéniques il suffit qu'un seul gène codant pour l'une des enzymes de la chaîne soit défectueux pour que le produit final ne soit pas synthétisé. Mais si des anomalies génétiques concernent plusieurs gènes de la chaîne (malanogénèse), le résultat se traduit dans tous les cas par une absence de pigmentation de la peau (albinisme).
Des génotypes différents peuvent conduire à un même caractère phénotypique: donc la simple observation du phénotype ne permet pas de déduire le génotype.
3.2 FACTEURS EXTERNES
Si chaque cellule contient l'intégralité de l'information génétique, seuls certains gènes s'y expriment , lui conférant ses caractères propres. Cette expression varie au cours du temps: inhibée, activée, ralentie, stimulée, elle est régulée. Des facteurs environnementaux l'influencent (ex: rayonnement solaire sur la synthèse de mélanine lors du bronzage).
L'intervention d'une protéine dans la réalisation du phénotype est elle-même dépendante de facteurs environnementaux.
Exemple: si une mutation en un endroit précis du gène de la ß-globine se traduit par la synthèse d'une hémoglobine anormale HbS, les conséquences pour un individu de la présence de cette protéine sont dépendantes de la concentration en dioxygène, de la température,... En tenant compte de ces facteurs ou en agissant sur l'environnement on peut ainsi modérer les effets néfastes de l'anomalie.
![]()
![]() En consultant le lien internet ci-dessus vous pourrez comprendre:
En consultant le lien internet ci-dessus vous pourrez comprendre:
la différence structurale entre HbS et HbA,
la structure du polymère,
le mécanisme de la polymérisation.
3.3 FACTEURS INTERNES
3.3.1 Existence de gènes de prédisposition à un caractère (maladie le plus souvent)
Ils ont été mis en évidence statistiquement et exposent le sujet à une plus grande probabilité d'exprimer la maladie, mais elle n'a rien d'inéluctable. Inversement, leur absence ne signifie pas que l'individu ne présentera pas ce caractère.
![]()
![]() Le cancer du sein est le plus fréquent des cancers de la femme, il touche une femme sur dix dans les pays occidentaux. En France, il est responsable de plus de 11 000 décès chaque année. Pas moins de 42 000 cancers du sein et 4 500 cancers de l'ovaire ont été détectés en l'an 2000. Parmi les différents risques, des facteurs familiaux et génétiques ont été identifiés: 5 à 10 % des cancers du sein et de l'ovaire seraient dus à une prédisposition génétique majeure, c'est-à-dire associés à un risque tumoral élevé.
Le cancer du sein est le plus fréquent des cancers de la femme, il touche une femme sur dix dans les pays occidentaux. En France, il est responsable de plus de 11 000 décès chaque année. Pas moins de 42 000 cancers du sein et 4 500 cancers de l'ovaire ont été détectés en l'an 2000. Parmi les différents risques, des facteurs familiaux et génétiques ont été identifiés: 5 à 10 % des cancers du sein et de l'ovaire seraient dus à une prédisposition génétique majeure, c'est-à-dire associés à un risque tumoral élevé.
Les formes héréditaires représentent ainsi chaque année 1 700 à 3 400 cas de cancers du sein et 160 à 320 cas de cancers ovariens. Ainsi les altérations des gènes BRCA1 et BRCA2 (BReast CAncer) sont-ils responsables de 95 % des formes familiales héréditaires de cancers du sein et de l'ovaire, et de 65 % des formes familiales du cancer du sein seul!
On pourra se rendre compte de la réalité de cette prédisposition en consultant le site:
http://www.medcost.fr/html/economie_sante_eco/mag_26/institut_curie.htm
et trouver une étude très complète (en anglais) sur le site canadien:
http://www.facingourrisk.org/resources.php
3.3.2 Le phénotype est multifactoriel
Il montre que la relation entre génotype et phénotype est complexe.
Des interactions entre gènes sont possibles , le milieu extérieur, l'alimentation, la consommation de tabac, d'alcool, de drogues, le mode de vie (pratique ou non d'activités physiques, par exemple les maladies cardio-vasculaires) influencent l'expression des gènes.
3.3.3 La médecine prédictive s'avère ainsi déterminante pour réduire de façon sensible les risques (par exemple, réduction d'un facteur 20 dans le cas des MCV: maladies cardio-vasculaires).
Par ailleurs, si le risque le justifie, le diagnostic génétique avant la naissance pourra éviter la mise au monde d'un enfant porteur d'une grave anomalie génétique (programme de Terminale S).




