Glucides
GLUCIDES
GÉNÉRALITÉS
Composés naturels, ils constituent l'infrastructure des végétaux. Ils jouent un rôle dans le stockage de l'énergie. Ils sont un élément fondamental de l'alimentation.
Ce sont des composés polyfonctionnels qui ont pour formule globale Cn(H2O)n, d'où le nom d'hydrates de carbones. Ils sont détaillés en plusieurs classes.
Les sucres, ou monosaccharides, ou oses. Ce sont des molécules de petites tailles, élément des glucides de grandes tailles.
Les Osides, ces derniers sont décomposables par hydrolyses en donnant des oses.
en Holosides composés d'oses uniquement
et en Hétérosides composés d'oses et de molécules dites aglycones relevant d'autre fonctions chimiques
Selon leur taille les holosides sont classés en:
Oligoholosides ou oligosaccharides comportant un nombre d'oses restreint <10
et Polyholosides ou polysaccharides comportant un grand nombre d'oses jusqu'à 3000.
La représentation de ces molécules suppose assimilée les représentations tridimensionnelles des molécules organiques notamment celles de Fischer et de Haworth (voir C32).
Les OSES.
Seuls seront vu dans ce programme, un aldohexose le glucose et un cétohexose le fructose.
Les aldoses ont une structure fonctionnelle commune dans leur forme linéaire. Il s'agit d'une chaîne d'alcools secondaires ayant à une extrémité un aldéhyde et à l'autre extrémité un alcool primaire.
Les cétoses ont une fonction cétone dans ls chaîne les autres carbones étant porteur d'une fonction alcool primaire ou secondaire selon la position dans la chaîne.
Il faut aussi signaler les désoxyaldoses dans lesquels une ou plusieurs fonctions alcools sont remplacées par des hydrogènes.
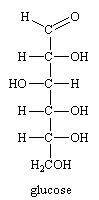
Le GLUCOSE.
C'est un aldohexose de formule globale C6H12O6 .
soit O=CH-CHOH-CHOH-CHOH-CHOH-CH2OH.
Sa configuration est 2R,3S,4R,5R. Selon Fischer il est de la série D et possède un pouvoir rotatoire positif (+). C'est un sucre naturel composant le sucre des fruits, du miel
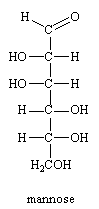
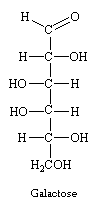
Il existe 4 carbones asymétriques, donc 16 stéréoisomères du glucose. Seuls deux d'entre eux sont des composés naturels le (+)-(D)-galactose et le (+)-(D)- mannose. Les autres isomères D et leur énantiomère L ont tous été synthétisés.
Réactivité.
Oxydo-réduction. Il a été vu que les aldéhydes étaient oxydés en acide carboxyliques, par le tartrate cuivrique ou Liqueur de Felhing et le nitrate d'argent ammoniacal ou réactif de Tollens.Ils conduisent à des acides aldoniques ou seule la fonction aldéhyde est modifiée en fonction acide carboxylique, mais leur intérêt est surtout analytique.
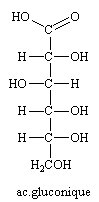
L'oxydation par le Brome du glucose n'oxyde que la fonction aldéhyde en donnant un acide aldonique, l'acide gluconique.
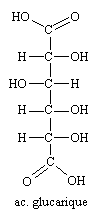
L'oxydation par l'acide nitrique oxyde aussi l'alcool primaire et donne un diacide, l'acide glucarique.
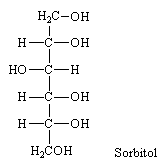
La réduction est réalisable par les réactifs habituels des aldéhydes, H2/métal; H-, qui donnent le sorbitol avec deux fonctions alcools primaires. On nomme alditols ces dérivés des aldoses ou des cétoses ne portant que des fonctions alcool. Le sorbitol est l'alditol du glucose. (entre autres, mais aussi du sorbose et du gulitol).
Action de la Phénylhydrazine.
Comme sur les aldéhydes, la phénylhydrazine donne une phényl hydrazone, mais la réaction s'étend à l'alcool secondaire du carbone voisin, si on ajoute deux moles de phénylhydrazine supplémentaires. Le mécanisme complexe n'est pas développé ici. Le produit obtenu est une double phényl hydrazone, appelée osazone, sur chacun des deux premiers carbones, on récupère une mole d'aniline, une d'ammoniac et une d'eau.
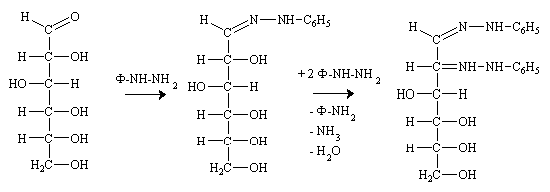
L'osazone cristallise facilement, ce qui simplifie la purification par recristallisation à fin d'analyse d'un sucre impur.
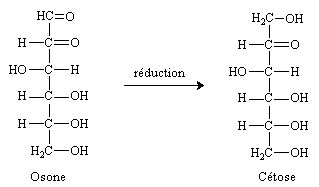
L'hydrolyse de l'osazone donne une osone composé  -dicarbonylé, qui peut être réduit en cétose par réduction sélective de l'aldéhyde terminal.
-dicarbonylé, qui peut être réduit en cétose par réduction sélective de l'aldéhyde terminal.
Des procédés spécifiques aux sucres permettent de rallonger ou de raccourcir le chaîne carbonée. Il s'agit de la dégradation de WOHL qui réduit le nombre de carbone et de la méthode de KILIANI qui l'augmente.
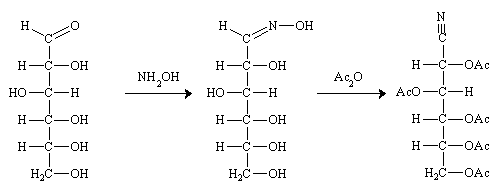
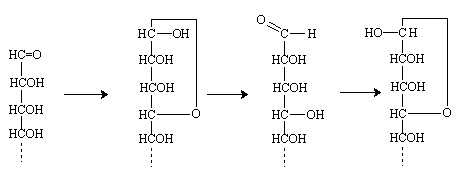
Dégradation de WOHL.
La première étape est la formation de l'oxime, sous l'action de l'hydroxylamine. L'oxime est déshydratée en nitrile (en fait une cyanhydrine due à la présence de l'alcool secondaire du carbone voisin), la cyanhydrine est coupée en acide cyanhydrique et en aldéhyde par Ag2O.(réaction inverse de la formation des cyanhydrines).
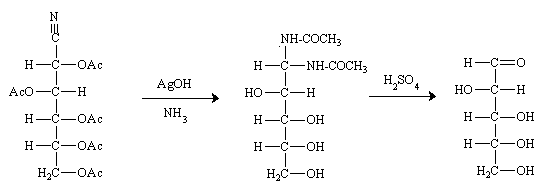
Méthode de KILIANI-FISCHER.
L'addition d'un carbone supplémentaire est obtenu par formation d'un cyanhydrine sous l'action de HCN sur la fonction aldéhyde. L'hydrolyse convertit la fonction nitrile en acide qui se lactonise avec l'alcool du C3 du sucre initial. La lactone est réduite par l'amalgame de sodium en aldéhyde et en alcool. Le bilan est donc l'allongement de la chaîne d'un carbone mais la réaction n'est pas stéréospécifique la nouveau carbone asymétrique (ex C1) est formé sous les deux configurations possibles.
Le glucose est fermentescible et donne dans un processus complexe, mais largement mis en application, de l'éthanol et du CO2. Les jus sucrés dilués donnent les boissons fermentées.(vins, bières, cidre, etc..). La distillation permet ensuite une séparation de l'éthanol, (vin/cognac et armagnac; bière/whisky; cidre/calvados etc.).
Formes cycliques. L'équilibre anomérique.
Les sucres présentent sur une même chaîne un aldéhyde et des fonction alcools. Or on a vu que en milieu acide les aldéhydes réagissent avec les alcools pour donner un hémi-acétal, puis un acétal. Dans le cas

présent la même réaction est possible au sein de la molécule. Cette réaction intramoléculaire est d'importance dans la chimie de cette famille.
Pour le glucose par exemple deux éléments sont à prendre en compte, d'une part sur quelle fonction alcool l'aldéhyde va réagir, d'autre part sur quelle face de l'aldéhyde l'alcool va se condenser?
L'expérience montre que les possibilités sont toutes réalisées.
Condensation C1/C5 et condensation C1/C4 (isomérie de posirion)
Condensation sur les deux faces de l'aldéhyde. (diastéréoisomérie)
La condensation C1/C5 donne un cycle à 6 éléments (5C et 1O) sous deux formes différenciées par la configuration du carbone 1.
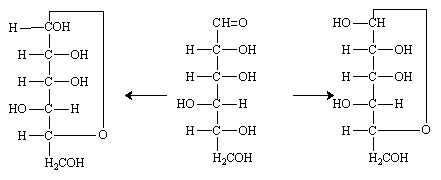
 -D-glucose
-D-glucose 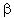 -D-glucose
-D-glucose
Cette représentation selon Fischer est précise, mais pas très évocatrice voici les mêmes structures sous diverses formes. Le cycle rappelle le pyrane, ces formes sont dites "pyranose".
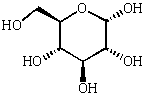
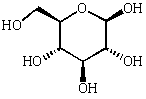
 -D-glucose
-D-glucose 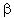 -D-glucose
-D-glucose
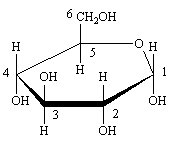
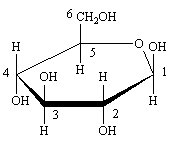
Forme de Haworth. Les n° sont ceux de la forme linéaire selon Fischer
En fait la molécule "réelle" est beaucoup plus proche des formes chaises du cyclohexane. En plaçant le groupe CH2OH en position équatoriale la représentation est la suivante.
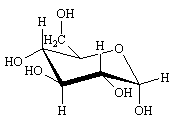
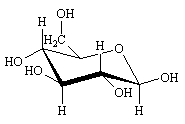
 -D-glucose
-D-glucose 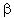 -D-glucose
-D-glucose
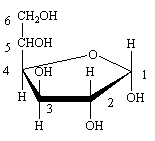
La condensation se fait aussi en C1/C4, elle conduit à un cycle à 5 éléments, dont l'oxygène, dans une forme qui rappelle le furane dite "furanose". Là encore deux diastéréoisomères  et
et 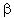 sont possibles, la différence portant sur la configuration du carbone 1.
sont possibles, la différence portant sur la configuration du carbone 1.
Voici selon Haworth l' -D-glucofuranose:
-D-glucofuranose:
L'ensemble de ces formes est en équilibre, qui est une tautomérie car la formule globale est invariante, seul un hydrogène se trouve déplacé.
Les formes  et
et 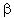 sont dites anomères. Le carbone n°1 dont la configuration est différente entre ces deux formes est dit "carbone anomérique".
sont dites anomères. Le carbone n°1 dont la configuration est différente entre ces deux formes est dit "carbone anomérique".
Conséquence la mutarotation.
L'équilibre est fortement déplacé vers les formes cycliques, dans le cas du glucose essentiellement pyranose ce qui n'est pas le cas pour tous les sucres.
A l'état cristallisé à partir de solutions concentrées, la presque totalité du D-glucose est sous la forme  -pyranose, qui a un pouvoir rotatoire spécifique de [
-pyranose, qui a un pouvoir rotatoire spécifique de [ ]25D = + 113°. Mis en solution dans l'eau cette valeur diminue jusqu'à 52,7° car il s'établit alors l'équilibre tautomère avec la forme
]25D = + 113°. Mis en solution dans l'eau cette valeur diminue jusqu'à 52,7° car il s'établit alors l'équilibre tautomère avec la forme 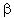 qui a un pouvoir rotatoire spécifique beaucoup plus faible de 18,7°.
qui a un pouvoir rotatoire spécifique beaucoup plus faible de 18,7°.
L'équilibre global a été mesuré dans l'eau à 25°C il donne:
36,4% de forme 
0.003% de forme ouverte
63,6% de forme 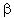
La forme 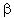 peut être obtenue pure par cristallisation dans l'acide acétique.
peut être obtenue pure par cristallisation dans l'acide acétique.
Cette variation du pouvoir rotatoire en solution du glucose mis en solution s'appelle mutarotation c'est une propriété générale de tous les monosaccharides.
LE FRUCTOSE.
C'est un cétohexose, c'est à dire que le carbonyle se trouve sur le carbone 2. Il est donc isomère du glucose.
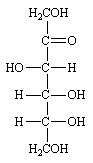 (-)-(D)-Fructose
(-)-(D)-Fructose
Il existe dans les fruits, d'où son nom, et dans les hydrates de carbones polymères naturels. Il est lévogyre et de la série D.
La réactivité de la fonction cétone est normale. Il donne une réaction positive à la liqueur de Felhing, mais ceci relève de la fonction  -hydroxycétone et non d'un aldéhyde.
-hydroxycétone et non d'un aldéhyde.
L'action de la phényl hydrazone donne la même osazone que le glucose ce qui suppose une configuration identique des carbones 2,3 et 4.
Le fructose présente aussi un équilibre tautomère avec des formes cycliques hémiacétaliques, mais contrairement au glucose il existe aussi sous forme de fructofuranose pour 30% et fructopyranose pour 70%. Chacune de ces formes présente un équilibre anomère.
Le fructose est aussi fermentescible que le glucose (ouf!).
LES OSIDES.
Bien qu'il existe des oses à l'état libre dans des tissus animaux ou végétaux, ils sont généralement soit sous forme polymère avec d'autres sucres (Holosides) soit associés avec d'autres molécules (Hétérosides). Les parties glucidiques de ces macromolécules sont généralement des cycles pyranoses ou furanoses et lorsque la liaison se fait sur la carbone anomère, il existe des variétés  et des
et des 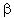 .
.
Selon que ces macromolécules sont de taille modeste (10 motifs,) on parle de Oligoholosides, ou de grande taille (3000 motifs) de polyholosides.
La liaison entre deux motifs est appelée liaison glycosidique.
LES OLIGOHOLOSIDES.
Ils sont formés de quelques molécules de sucres reliées par une liaison glycosidique (éther) après élimination d'eau.
Plusieurs cas sont à considérer
selon la nature du ou des sucres monomères.
la nature du cycle (pyranose/furanose),
le type de carbone de liaison anomère ou pas
la configuration du carbone anomère,  ou
ou 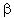 s'il est lié.
s'il est lié.
Les DIHOLOSIDES. Saccharose, maltose, lactose et cellobiose.
Le Saccharose est le sucre de canne ou de betterave. C'est un composé économiquement important voire stratégique. (Blocus continental ).
Il est formé d'une liaison D-glucose/D-fructose, qu'ils libère par hydrolyse. Cette réaction est réalisable en milieu acide dilué, soit par une invertase. Cette réaction est nommée inversion du saccharose, car le saccharose est dextrogyre et ses produits d'hydrolyse lévogyres.

le glucose est sous forme pyranose, lié par le carbone anomérique en  , le fructose est sous forme furanose, lié par le carbone anomérique en
, le fructose est sous forme furanose, lié par le carbone anomérique en 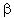 .
.
La liaison éther n'est plus réductrice et le saccharose ne peut réagir à la liqueur de Felhing.
Le Maltose est un constituant de l'amidon et en est formé par l'hydrolyse de ce dernier. Il est hydrolysable en deux molécules de glucose.
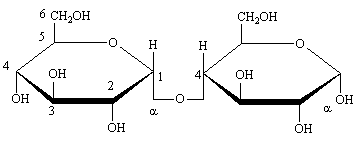
La liaison glycosidique est établie entre un glucopyranose sur le carbone anomérique en  et un second
et un second  -glucopyranose sur le carbone 4.
-glucopyranose sur le carbone 4.
Le carbone anomérique du second glucose n'étant pas pris dans la liaison, il peut donner une mutarotation et il existe une forme  et une forme
et une forme 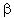 du maltose. La forme ouverte est elle même possible, ce sucre est réducteur et peut réagir par sa fonction aldéhyde. Il donne une osazone.
du maltose. La forme ouverte est elle même possible, ce sucre est réducteur et peut réagir par sa fonction aldéhyde. Il donne une osazone.
Le Lactose se trouve pour 5% dans le lait, il est composé de glucose et de galactose.

 -lactose
-lactose
Le Cellobiose est un produit de la dégradation de la cellulose. Il est très proche du maltose sauf dans la configuration 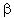 du carbone anomère du premier glucose.
du carbone anomère du premier glucose.
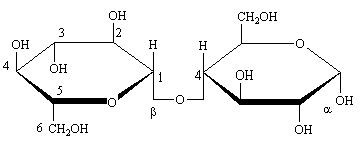
 -cellobiose
-cellobiose
Les POLYHOLOSIDES.
Ce sont des polymères de masse molaire très élevée, résultant de la condensation d'un grand nombre de molécules d'oses. Ce sont la cellulose, l'amidon et le glycogène.
La Cellulose: Elle est constituée d'un enchaînement de 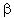 -glucopyranose liés en C1
-glucopyranose liés en C1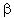 /C4. On y retrouve la structure du
/C4. On y retrouve la structure du 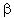 -cellobiose. La masse molaire est évaluée à 500 000 soit 1500 enchaînements cellobiose, mais des mesures conduisent à des valeurs nettement supérieures allant jusqu'à 12 000.
-cellobiose. La masse molaire est évaluée à 500 000 soit 1500 enchaînements cellobiose, mais des mesures conduisent à des valeurs nettement supérieures allant jusqu'à 12 000.
C'est le constituant de la paroi des cellules végétales. Le coton, comme le papier filtre, est constitué de 98% de cellulose. Le bois et la paille en contiennent 50%.
Son hydrolyse fournit du cellobiose, puis du glucose. L'homme ne peut l'assimiler, mais les ruminants y arrivent par voie enzymatique.
La cellulose est très utilisée sous forme de coton, papier sans grande transformation de sa structure. Elle est aussi transformée par l'acide nitrique en nitrocellulose dans laquelle des groupes hydroxyles sont estérifiées en esters nitriques R-O-NO2. Si la nitration est poussée elle donne un composé explosif utilisé comme poudre sans fumée. Un nitration moins intense donne le Celluloïd qui est une des premières matières plastiques. Utilisé longtemps comme support de matière sensible en photographie et cinématographie, son usage est abandonné du fait de sa grande inflammabilité et de sa conservation difficile.
Une autre utilisation est la Rayonne ou Vicose et la Cellophane. Elle proviennent d'un procédé de mise en solution et de reprécipitation de la cellulose. D'abord mis en solution par nitrification et reprécipitation par dénitrification en milieu basique (procédé Chardonnet 1884), puis par formation de xanthate en milieu basique par CS2 et reprécipitation en milieu acide (procédé Cross-Bevan 1892 ), la cellulose est mise en solution en immobilisant les liaisons OH afin d'interdire les nombreuses liaisons hydrogènes intermoléculaires qui rendent ce composé rigide et insoluble dans l'eau.
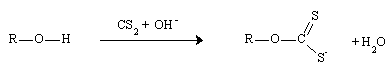
Formation d'un xanthate hydrosoluble de cellulose.
L'AMIDON.
Il est composé d'amylose pour 20% et d'amylopectine pour 80%.
C'est une molécule fondamentale pour l'alimentation humaine d'une grande partie de la planète, populations sédentaires et agricole, mangeur de blé, riz, maïs, pomme de terre, manioc, igname etc.
Dans les plantes il constitue le matériel nutritif de réserve.
Comme la cellulose l'amylose est un polymère linéaire du glucose. Il est soluble dans l'eau chaude et dans l'eau froide La jonction est C1 /C4.Ce qui conduit à un motif maltose, et c'est ce disaccharide qu'on obtient par hydrolyse de l'amylose. La masse molaire de l'amidon est plus faible que celle de la cellulose, environ 200 glucose soit 36000. La différence de géométrie de la jonction glycosique entraîne une structure en hélice
/C4.Ce qui conduit à un motif maltose, et c'est ce disaccharide qu'on obtient par hydrolyse de l'amylose. La masse molaire de l'amidon est plus faible que celle de la cellulose, environ 200 glucose soit 36000. La différence de géométrie de la jonction glycosique entraîne une structure en hélice
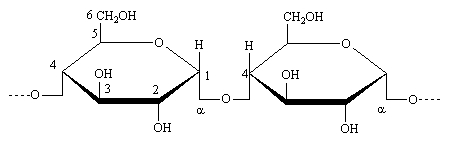 Amylose
Amylose
L'amylopectine est une chaîne ramifiée. Elle présente une liaison sur le C1 /C6 toutes les 20 à 25 unités glucoses. Sa masse molaire est importante de plusieurs millions.
/C6 toutes les 20 à 25 unités glucoses. Sa masse molaire est importante de plusieurs millions.
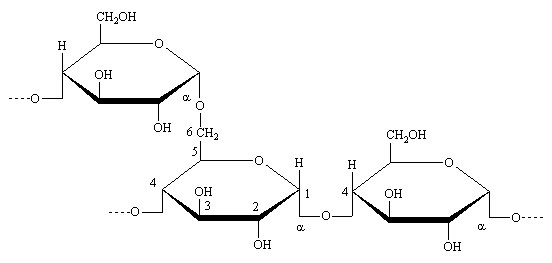
Le Glycogène.
De structure analogue à l'amylopectine, mais dont les branchement C1 /C6 sont plus fréquents, environ toutes les dix unités glucose, a une masse molaire beaucoup plus importante pouvant atteindre 100 millions. C'est un composé d'origine animale destiné au stockage de l'énergie, qui permet la libération rapide du glucose pour maintenir un taux de glycémie constant dans le sang après un effort intense.
/C6 sont plus fréquents, environ toutes les dix unités glucose, a une masse molaire beaucoup plus importante pouvant atteindre 100 millions. C'est un composé d'origine animale destiné au stockage de l'énergie, qui permet la libération rapide du glucose pour maintenir un taux de glycémie constant dans le sang après un effort intense.
Les HETEROSIDES.
Les hétérosides ou glycosides, sont constitués de sucres et de molécules appartenant à d'autres fonctions appelées aglycones.
Là encore les liaisons sur le sucre sont faites sur le carbone anomère (C1) et donnent lieu à des jonctions  ou
ou 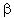 , conduisant à des
, conduisant à des  -hétérosides ou des
-hétérosides ou des 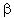 -hétérosides. Sur l'aglycone l'atome assurant la liaison peut être un oxygène (O-hétérosides) ou un azote (N-hétérosides).
-hétérosides. Sur l'aglycone l'atome assurant la liaison peut être un oxygène (O-hétérosides) ou un azote (N-hétérosides).
Exemple. Présent dans les végétaux se sont le plus souvent des 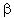 -glucopyranosides, c'est à dire que l'aglycone est lié en
-glucopyranosides, c'est à dire que l'aglycone est lié en 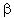 sur un gucopyranose.
sur un gucopyranose.
C'est la cas de l'amygdaline présente dans les amandes amères et certains noyaux de fruits.
 Amygdaline
Amygdaline
La coniférine est trouvée dans la sève des conifères.
 Coniférine.
Coniférine.
Acide Nucléïques.
Ce sont des N-hétérosides. La partie glucidique est un D-ribose ou un desoxy-D-ribose. L'aglycone est une base du groupe de la pyrimidine ou de la purine. Ils sont de grande importance en biologie.
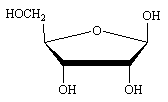 (D)-ribose
(D)-ribose 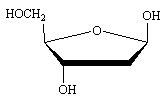 Desoxy-(D)-ribose
Desoxy-(D)-ribose
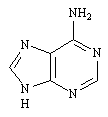
L'Adénosine est un ribonucléoside dont la base est l'adénine.
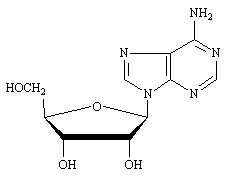 Adénosine.
Adénosine.
Les acides ribonucléïques (ARN) et désoxyribonucléïques (ADN) présents dans le noyau des cellules sont formés de la réunion de tels hétérosides en très grand nombres (3000 à 10 millions). La jonction est assurés par de l'acide phosphorique qui estérifie les fonctions alcools des carbone en 3 et en 5 du cycle du glucide. Un nucléotide est une unité de cas polymères qui comprend un ensemble glucide + acide + base.

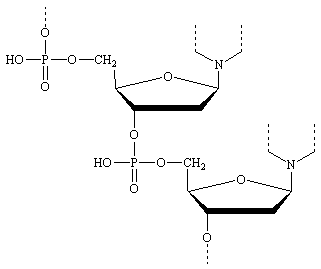 enchaînement d'un ADN
enchaînement d'un ADN
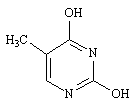
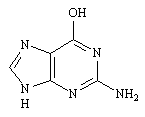
Les cycles glucidiques d'un acide nucléique portent des bases différentes. Bien que seules quatre bases soient utilisées le nombre de variations est colossal. Ces bases sont l'adénine, la guanine, la thymine, et la cytosine.
|
Bases pyrimidiniques |
|
Bases puriques |
|
|
|
|
|
|
|
Thymine |
Cytosine |
Adénine |
Guanine |
|
|
|
|
|
Par association avec des protéines ces ADN forment les désoxyribonucléoprotéines dont sont constitués les chromosomes, et qui jouent un rôle essentiel dans la biosynthèse des protéines spécifiques à l'espèce et à l'individu.


 Pyrimidine
Pyrimidine Purine
Purine