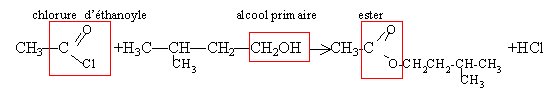
Estérification avec un chlorure d’acyle et saponification
Conditions d’achèvement
URL source du document
Document
estérification, hydrolyse, saponification |
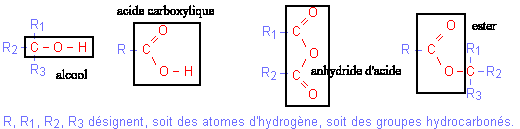
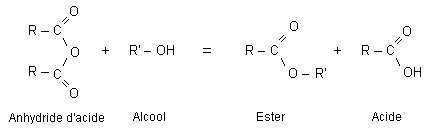
l'action d'un chlorure d'acyle ou d'un anhydride d'acide (R-CO)2O sur un alcool donne un esterla réaction est totale |
|
|
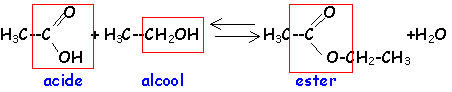
l'action d'un acide carboxylique sur un alcool donne un ester et de l'eaula réaction est limitée par l'hydrolyse de l'ester, athermique, lenteLa réaction d'hydrolyse d'un ester est la réaction entre un ester et l'eau conduisant à un acide carboxylique et à un alcool. Cette réaction d'hydrolyse est la réaction inverse de la réaction d'estérification. |
|
Estérification et hydrolyse constituent une réaction réversible aboutissant à un équilibre chimique où les quatre composés coexistent dans des proportions constantes ( équilibre dynamique : les deux réactions continuent d'avoir lieu mais avec des vitesses égales, la composition à l'équilibre ne change pas.).
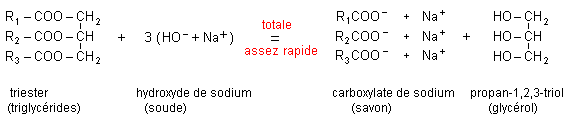
L'hydrolyse basique d'un ester ( ou saponification) est la réaction de l'ion hydroxyde HO - avec cet ester. On obtient un ion carboxylate et un alcool. La saponification d'un ester est une réaction assez rapide et totale. L'avancement final est égal à l'avancement maximal. Le taux d'avancement final est égal à 1.
Les corps gras sont des triesters du propan-1, 2, 3-triol ( glycérol) et d'acides gras (acide à chaîne non ramifiée, à nombre pair d'atomes de carbone, en général de 10 à 20 atomes C).
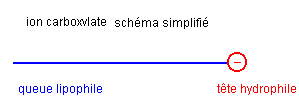
Un savon est hydrophile, lipophile, amphiphile
L’ion carboxylate du savon possède une extrémité négative attirée par l'eau. Cette extrémité est hydrophile (amie de l'eau).L'ion carboxylate possède également une chaîne carbonée lipophile (amie des lipides ).L'ion carboxylate possèdant une partie lipophile et une partie hydrophile est un amphiphile.La partie hydrophile est lipophobe (peur des lipides) et la partie lipophile est hydrophobe (peur de l'eau).Un savon est peu actif :- dans une eau très calcaire car les ions carboxylate R – COO - constituants le savon précipitent avec l’ion Ca2+ ou Mg2+.- en milieu acide car une partie des ions carboxylate disparaît ( déplacement de l'équilibre acide / base vers la forme acide AH)- dans une eau salée car, en présence des ions Na+, l'équilibre suivant évolue vers la droite :R-COO- (aq) + Na+ (aq) = R-COONa(s) |
Modifié le: mardi 26 juillet 2016, 12:30