Électrolyse et synthèse de l'eau
Electrolyse et synthèse de l’eau
1- Electrolyse de l’eau
1.1- Définitions
- L’électrolyse de l’eau est la décomposition de l’eau par le courant électrique
- L’électrolyseur (voltamètre) est muni de deux électrodes :
- L’anode : entrée du courant (+)
- La cathode : sortie du courant (-)
1.2- Expérience
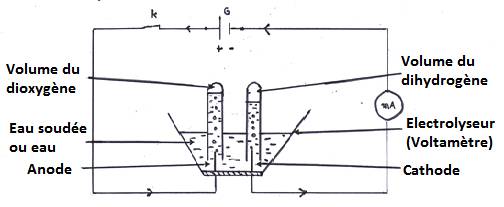
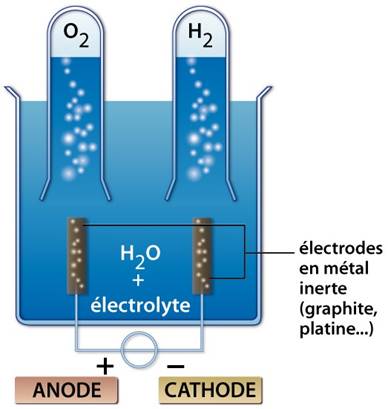
1.3- Interprétation et résultat
L’électrolyse contient uniquement de l’eau. le circuit étant fermé, on n’observe rien ; l’eau est faiblement conductrice du courant électrique.
En y ajoutant quelques gouttes de soude, des bulles gazeuses se dégagent du nouveau de chaque électrode : la soude rend l’eau conductrice du courant électrique.
Le volume de gaz obtenu à la cathode est le double de celui du gaz à l’anode.
On va identifier ces deux gaz.
a) Identification de gaz à la cathode
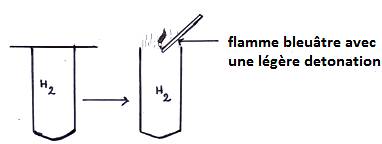
On obtient un gaz incolore et inodore qui, à l’approche d’une flamme, brûle après une légère détonation : c’est le dihydrogène.
b) Identification du gaz à l’anode
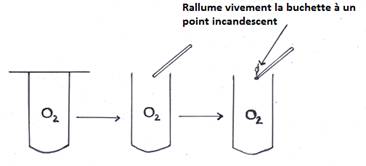
On obtient un gaz incolore et inodore qui rallume vivement une buchette présentant un point incandescent : c’est le dioxygène.
1-4 Conclusion
L’électrolyse de l’eau permet d’obtenir du dihydrogène à la cathode du dioxygène à l’anode le volume du dihydrogène est le double du volume du dioxygène.
![]()
![]()
1-5 Equation – bilan
Ecriture bilan
Eau → Dihydrogène + Dioxygène
Equation bilan
2H2O → 2H2 + O2
2- Synthèse de l’eau
2.1- Définition
La synthèse de l’eau est la formation de l’eau à partir du mélange réactionnel de dihydrogène et de dioxygène.
2.2- Expérience
a) synthèse eudiométrique
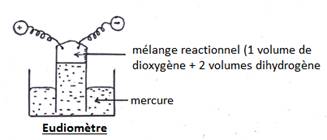
- on déclenche des étincelles électriques au niveau des électrodes pour amorcer la réaction.
- La pression des gaz baisse, le niveau de mercure qui va remonter lorsque les deux gaz réagissent en formant une buée (eau) sur la paroi interne du tube eudiométrique.
b) combustion de mélange détonnant
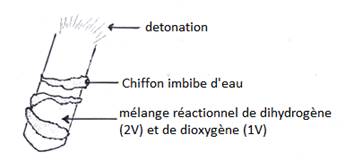
2.3- Conclusion
La synthèse est un phénomène inverse de l’électrolyse (synthèse ≠ analyse ou l’électrolyse)
2.4- Bilan de la réaction
Ecriture bilan
Dihydrogène + Dioxygène → eau
Equation bilan
2H2 + O2 → 2H2O
Exercice résolu 3
Lors d’une expérience sur l’électrolyse de l’eau, on a recueilli 480cm3 de dihydrogène.
1- Sur quelle électrode recueillit-on le gaz dihydrogène ?
2- Calculer le nombre de moles de dihydrogène recueilli.
3- Ecrire l’équation bilan de cette réaction chimique.
4- Calculer la masse d’eau à décomposer.
On donne Vm =24L.mol-1 ; MO = 16g.mol-1 ; MH = 1g.mol-1
Solution
1) On recueillit le gaz dihydrogène sur la cathode.
2) Nombre de moles de dihydrogène :
24L de H2 → 1 mol
480 cm3 =
0,48L de H2 →![]()
3) Equation bilan : 2H2O → 2H2 + O2
4) Masse d’eau à décomposer :
Masse molaire MH2O = (2 x 1) + 16 = 18g.mol-1
Nombre
de moles ![]()
Ainsi,
![]()