Solution acide base neutre
Chapitre 2 : Solution acide, basique et neutre
1- Caractérisation par le BBT
Le bleu de bromothymol noté BBT est une substance qui, dissoute dans l’alcool, donne une solution orangée. Il permet de connaître la nature d’une solution : acide, basique, neutre.
1.1- Action de BBT sur une solution acide
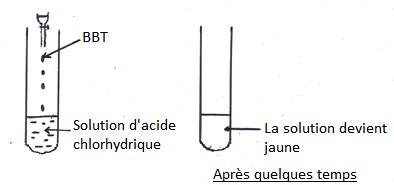
- une solution, dans laquelle vire au jaune, est acide
- même résultat avec une solution d’acide sulfurique, acide nitrique, jus de citron, … Ces solutions sont acides.
1.2- Action de BBT sur une solution basique
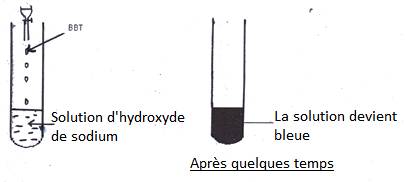
Une solution, dans laquelle le BBT vire au bleu, est basique. Même résultat avec l’eau savonneuse, solution d’ammoniac.
1.3- Action de BBT sur une solution neutre
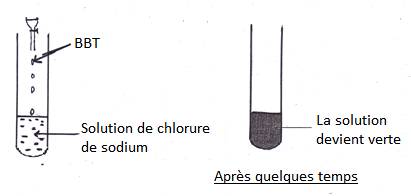
Une solution, dans laquelle le BBT vire au vert, est neutre.
2- Les ions responsables des caractères acide et basique
L’ion H+ est responsable de l’acidité
L’ion OH- est responsable de la basicité.
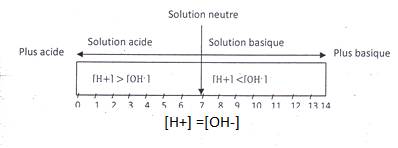
Remarques :
[H+] > [OH-] : acide
[H+] < [OH-] : basique
[H+] = [OH-] : neutre
3- pH d’une solution aqueuse
Le pH est une échelle de nombre pour tester l’acidité, la basicité ou la neutralité d’un milieu.
pH : potentiel d’hydrogène.
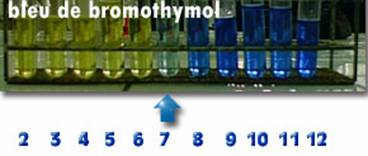
Remarque :
Les valeurs du pH ne sont pas forcément des nombres entiers naturels.


