Combustion vive et lente du fer
Chapitre 4 : COMBUSTIONS VIVE ET LENTE DU FER
1- Combustion vive du fer
1-1 Expérience
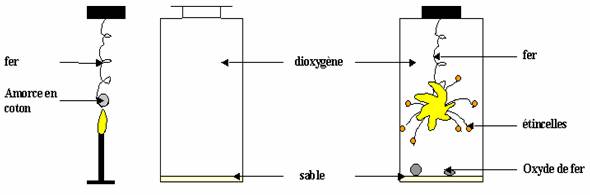
La paille de fer incandescente (Fig.1) introduite dans un flacon contenant du dioxygène brûle d’un éclat vif avec des étincelles (Fig.2).
1-2 Résultat et interprétation
Un corps noir grisâtre pouvant-être attiré par un aimant se forme.
La combustion vive du fer produit un solide noir grisâtre (attiré par un aimant) appelé oxyde magnétique de formule Fe3O4.
1-3 Bilan de la réaction
Ecriture- bilan
Fer + Dioxygène → Oxyde magnétique
Equation – bilan
3Fe
+ 2O2
![]() Fe3O4
Fe3O4
Remarque:
Pour obtenir une mole d’oxyde magnétique, il faut brûler 3 moles du fer dans 2 moles dioxygène
2- Combustion lente du fer
2-1 Expérience

2-2 Résultat et Interprétation
Lorsque le clou en fer est exposé dans l’air humide, il est oxydé ; la rouille se forme.
C’est la combustion lente du fer.
La formation de la rouille nécessite trois réactifs : le fer, le dioxygène et l’eau.
La rouille est un mélange complexe dont les principaux constituants sont : l’oxyde de fer III (Fe2O3), l’hydroxyde de fer III (Fe(OH)3)
2-3 Conclusion
La formation de la rouille est une réaction lente. Elle se produit à froid avec l’air humide.
La rouille est constituée de l’oxyde ferrique Fe2O3.
2-4 Bilan de la réaction
Ecriture –bilan
Fer + Dioxygène → Oxyde ferrique
Equation- bilan
4Fe + 3 O2 → 2Fe2O3
2-5 Protection de fer contre la rouille
Pour protéger le fer :
-Il faut l’isoler de ses réactifs enfin d’empêcher la formation de la rouille.
- Il faut le garder à l’abri de l’air humide.
- On couvre le métal fer d’une colle, de peinture, d’huile, de vernis, de graisse …
- On couvre d’un autre métal inoxydable (chrome ; nickel, or, argent).
Exercice résolu 5 :
On fait brûler vivement 16,8g de fer dans du dioxygène.
1- Ecrire l’équation bilan de la combustion
2- Calculer le volume de dioxygène nécessaire à cette combustion.
3- Calculer la masse d’oxyde magnétique obtenu.
On donne : MFe = 56g.mol-1 ; MO = 16g.mol-1
Solution :
1- Equation bilan de la réaction :
3Fe + 2O2 → Fe3O4
2- Le volume de dioxygène nécessaire :
(3 х56 = 168g) de Fe → (2 х 22,4L) de O2
16,8g
de Fe → ![]()
3- La masse d’oxyde magnétique obtenu :
168g de Fe → 232 g de Fe3O4
168g
de Fe →![]()

