Combustion des alcanes
Chapitre 3 : COMBUSTION DU BUTANE
1-Hydrocarbure
1.1- Définition
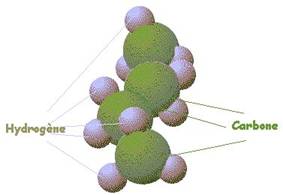
Un hydrocarbure est un composé moléculaire formé uniquement d’atomes d’hydrogène et de carbone.
On trouve les hydrocarbures dans l’état solide (paraffine), liquides (Essence, gazole, kérosène, …) ou gazeux (butane).
1.2- Alcanes
Les alcanes sont des hydrocarbures c’est-à-dire des composés moléculaires formés d’atomes de carbone et d’hydrogène.
|
||
|
|
n = 1 |
CH4 : méthane |
|
n = 2 |
C2H6 : éthane |
|
n = 3 |
C3H8 : propane |
|
n = 4 |
C4H10 : butane |
2- La combustion du butane
2-1 Expérience
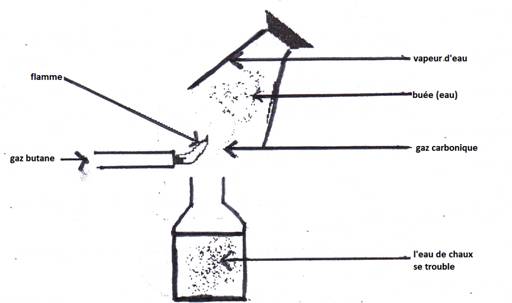
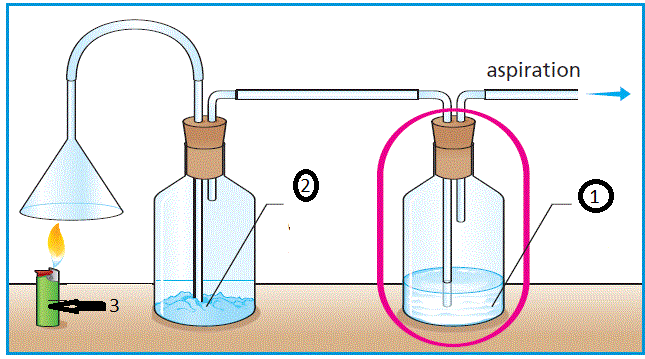
2-2 Résultat et interprétation
L’eau de chaux est troublée : le verre contient du dioxyde de carbone (gaz carbonique)
Le gaz butane réagit avec le dioxygène de l’air pour donner le dioxyde de carbone (CO2) et de l’eau (H2O).
2-3 Bilan de la réaction
Ecriture – bilan
butane + dioxygène → dioxyde de carbone + eau
Equation- bilan
2C4H10 + 13O2 → 8CO2 + 10H2O
2 moles 13 moles 8 moles 10 moles
2-4 Conclusion
La combustion complète des alcanes donnent de l’eau et du gaz carbonique selon l’équation – bilan :
2CnH2n+2 + (3n+1) O2 → 2n CO2 + (2n+2) H2O
Remarque :
Lorsque la combustion est incomplète il y a une formation de monoxyde de carbone (CO) et de carbone (C).
Exercice résolu 4 :
On fait brûler 1044g de butane dans du dioxygène.
1- Calculer le nombre de moles de butane utilisé.
2- Calculer le volume du gaz butane utilisé.
3- Ecrire l’équation bilan de cette combustion.
4- Calculer :
a) Le volume du gaz carbonique obtenu.
b) La masse d’eau formée.
c) Le volume de dioxygène nécessaire à cette combustion.
On donne : V = 22,4L.mol-1 ; MO = 16g.mol-1 ; MC = 12g.mol-1 ; MH = 1g.mol-1
Solution :
1) Nombre de moles de butane utilisé
La masse moléculaire du butane C4H10 est :
MC4H10 = (12 x 4) + (1 x 10) = 48 +10 = 58g.mol-1
58g → 1mol de C4H10
1044 g → n
D’où ![]()
2) Le volume de gaz butane utilisé
Le volume d’un gaz dans les CNTP est 22,4L.mol-1
On a alors 1 mol de C4H10
occupe un volume 22,4L, et 18 mol :![]()
3) Equation bilan de la combustion
2C4H10 + 13O2 → 8CO2 + 10H2O
4)
a- Volume de gaz carbonique obtenu
2(58)g de C4H10 → (8 x 22,4)L de CO2
1044g → ![]()
b- La masse d’eau formée
2(58)g de C4H10 →10(18)g de H20
1044g →![]()
c- Le volume de dioxygène nécessaire à cette combustion
2(58) g de C4H10 → 13(22,4) L de O2
1044g → ![]()