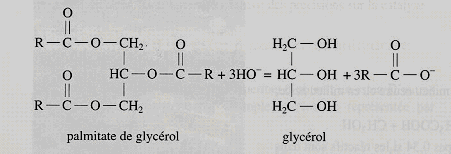Le savon: son histoire, sa fabrication et ses propriétés
Conditions d’achèvement
Le savon : son histoire, sa fabrication et ses propriétés.
Source : Texte extrait du site « tout sur les bulles ».
http://toutsurlesbulles.free.fr/site/lesavon.html
Le savon est une matière aux pouvoirs bien étranges. Lorsqu’on le mélange à l’eau, les propriétés de ce liquide changent radicalement. Une eau savonneuse devient capable de nettoyer la plupart des surfaces. Elle peut aussi emprisonner de l’air pour former des bulles. Qu’est-ce qui donne aux savons de telles capacités ? Aucune magie là-dedans, c’est leur structure chimique qui explique comment ils agissent.
Histoire du savon
Des documents datant de l’Antiquité mentionnent l’usage de nombreuses matières savonneuses et d’agents nettoyants, fabriqués de manière empirique à partir de cendres et de graisses. Dés le 1er siècle ap. J.C, le naturaliste romain Pline l’Ancien décrivait différentes formes de savons durs ou mous et colorés : les rutilandis capillis, dont les femmes se servaient pour se laver les cheveux et leur donner du lustre. Au 8ème siècle, la fabrication industrielle de savons était courante en Italie et en Espagne. Et c’est au 13ème siècle que la France commença à produire industriellement du savon fabriqué à base, essentiellement, de suif de chèvre et de cendres de hêtre (alcali). Vers 1500, les Français mirent au point un savon à base d’huile d’olive en vue de remplacer les graisses animales ce qui était beaucoup moins cher. Cette pratique fut exportée en Angleterre où la production de savon eu beaucoup de succès.
On découvrit ensuite rapidement que le savon peut être produit à partir de graisses extraites de nombreuses espèces vivantes : le suif, la graisse, les huiles de poissons et les huiles végétales, telles que l’huile de coprah (noix de coco), l’huile d’olive, l’huile de palme, l’huile de soja ou l’huile de mais. La fabrication du savon fut révolutionnée en 1791par le chimiste français Nicolas Leblanc, qui mit au point un procédé permettant d’obtenir de la soude caustique à partir du sel de cuisine. Cette soude était capable de réagir avec les graisses pour former du savon beaucoup plus efficace que l’alcali. En 1783, le chimiste suédois Carl Scheele avait fait bouillir de l’huile d’olive avec de l’oxyde de plomb et obtenu une substance au goût sucré qu’il avait appelé Ölsuss et que l’on connaît maintenant sous le nom de glycérine. En 1823, le chimiste français Eugène Chevreul, poussé par cette découverte, découvrit que ce ne sont pas les corps gras qui se combinent avec l’alcali pour former le savon, mais qu’ils sont d’abord décomposés en acides gras et en glycérine (ou glycérol). Chevreul est ainsi à l’origine de la théorie de la saponification.
Quelques savons
Savons durs : soude avec huiles et graisses contenant un fort pourcentages d’acides gras saturés.
Savons mous ou semi fluides : potasses avec huile de linette, huile de graine de coton ou huiles de poissons.
Savon pour le lavage à l’eau de mer : potasse et huile de coprah.
Savon blanc (savon de toilette de luxe) : potasse avec huile d’olive de premier choix
Savon à barbe : contient des stéarates de potassium et de sodium pour une mousse persistante.
Crème à raser : savon à barbe avec huile de coprah.
Savon de Marseille : 63% d’acides gras et résiniques et 28% d’eau
Savonnettes : copeaux de savon de Marseille avec du beurre de karité.
Comment obtenir du savon à partir d’une huile alimentaire
• Introduire, dans un ballon de 250mL :
20mL d’huile de cuisine
10mL de solution de soude commerciale
15mL d’éthanol
• Adapter au ballon un réfrigérant vertical
• A l’aide d’un chauffe-ballon électrique, porter le liquide à ébullition douce pendant une vingtaine de minutes.
• Verser ensuite le mélange dans un verre à pied contenant de l’eau salée. Une phase solide se forme : le savon est insoluble dans l’eau salée.
• Filtrer sur un entonnoir ou un buncher muni d’un papier filtre.
• Laisser sécher sur un verre de montre ou dans un moule.
Saponification et fabrication
La saponification est une réaction chimique par laquelle le savon est formé à partir d’acides gras (ou esters) et de soude. Cette réaction se produit dans un grand chaudron où l’on mélange l’huile et la soude. Après plusieurs heures de chauffage, on obtient du savon dans de l’eau. En fait, on traite les corps gras (stéarine ou oléine) en solution aqueuse par un alcali, en général la soude (hydroxyde de sodium, NaOH) ou la potasse (hydroxyde de potassium, KOH). Ils se décomposent sous l’action de la chaleur en formant de la glycérine et le sel de l’acide gras utilisé (stéarate de sodium, oléate de sodium). La saponification de la palmitine produit du palmitate de sodium (savon) et de la glycérine.
La saponification est suivie de la cuisson. Puis le produit est lavé plusieurs fois pour isoler le glycérol et ainsi purifier le savon de sa soude. Ce dernier est ensuite soumis à la liquidation (repos de la pâte pendant deux jours et lavage), puis transformé en fonction de la forme finale recherchée (moulage, séchage, addition de parfums…).
Au point de vue chimique…
Les corps gras sont des triesters du glycérol et d’acides dont le squelette comporte entre 12 et 22 atomes de carbone. Ces esters appelés glycérides sont des constituants des huiles végétales.
Lors d’une hydrolyse basique, c'est-à-dire lors de la réaction d’un ester avec l’eau en milieu basique, les corps gras donnent des ions carboxylates à longue chaîne carbonée. Leur sel de sodium est appelé le savon. L’hydrolyse basique est plus connue sous le nom de saponification dont l’équation de réaction est :
Equation générale de l’hydrolyse basique d’un corps gras. Dans le cas du palmitate de glycérol, R = C15H31.
Lors de la préparation d’un savon, l’hydrolyse basique du corps gras est suivie d’une réaction de précipitation. Pour cela, une solution concentrée de chlorure de sodium est ajoutée à la fin de l’hydrolyse basique. La précipitation qui fournit le savon RCOONa(s) est représentée par l’équation : RCOO_(aq) + Na+(aq) = RCOONa(s)
Cette opération porte le nom de relargage.
L’espèce chimique RCOONa dont le groupe d’atomes R comprend une longue chaîne hydrocarbonée est appelée savon. Dans l’ion carboxylate, le groupe d’atomes R est hydrophobe (qui évite l’eau) ou lipophile (lipos =graisse ; philos = ami)) : c’est la queue de la molécule de savon et le groupe d’atomes COO_ est hydrophile (qui a de l’affinité pour l’eau) : c’est la tête de la molécule de savon. Cette molécule est un tensioactif (elle modifie la tension superficielle des liquides dans lesquels elle se trouve).
L’affinité des atomes du groupe R de l’ion carboxylate pour les solvants organiques ou les graisses est grande car ces derniers possèdent de nombreuses liaisons apolaires (non polaires) C-H et C-C. Le groupe d’atomes R est donc dit lipophile ou hydrophobe.
En revanche, le groupe d’atomes COO-, comportant une charge négative et de nombreux doublets non liants forme une partie polaire. Ce groupe d’atomes est donc hydrophile. b
L’ion carboxylate, à la fois polaire et apolaire, est dit amphiphile. Son caractère amphiphile explique les propriétés caractéristiques su savon :
• L’eau savonneuse permet de faire des bulles
• Les savons sont de précieux agents de nettoyage
• Les savons stabilisent les émulsions (mélanges eau et huile)
En effet, les ions carboxylates en ayant leur partie hydrophobe en interaction avec les molécules organiques et leur partie hydrophile en interaction avec les molécules d’eau, peuvent empêcher les émulsions de se séparer en une phase grasse (huile) et une phase aqueuse (eau).
Lorsque le savon se mélange à l’eau, les têtes hydrophiles s’associent à l’eau et les queues hydrophobes tentent de la fuir. Les molécules se déploient à la surface pour former un film d’une extrême finesse. A la surface de l’eau, les molécules se séparent pour exposer leur queue hydrophobe à l’air (lui- même hydrophobe) et leur tête hydrophile face à l’eau. Si on mélange l’eau et le savon, les parties hydrophobes vont s’associer entre-elles et exposent les têtes à l’eau pour former des micelles.
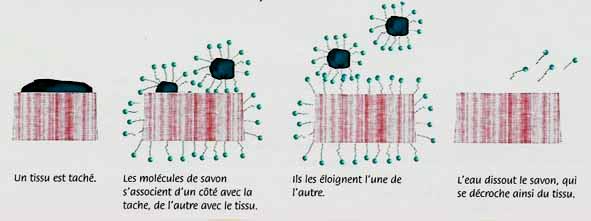
Pourquoi le savon lave-t-il ?
Pour enlever une tache, sur un tissu, il faut mettre du savon dans l’eau car l’huile (par exemple) étant hydrophobe, elle ne se mélange pas à l’eau. Si on ajoute du savon dans de l’eau, les queues vont s’accrocher sur la tache (la tête étant tournée vers l’eau). Lorsqu’on frotte, la tache se détache du tissu formant ainsi une micelle. Cette dernière ne colle pas au tissu car sa surface est hydrophile ? Le rinçage emporte le savon et la tache.
Et dans la nature, existe-t-il des molécules amphiphiles ?
Il faut se rappeler que les composés dont on tire le savon sont des graisses animales ou végétales. La nature a donc utilisé les graisses avant l’homme pour des fonctions différentes : le stockage de l’énergie et la conservation de la chaleur du corps. Mais les graisse telles qu’on les prélève chez les animaux, sont combinées entre elles et avec d’autres molécules : elles ne sont pas amphiphiles, elles ne possèdent pas de partie hydrophile.
Il existe cependant des molécules amphiphiles dans tous les êtres vivants. Car la nature a utilisé les propriétés étonnantes de molécules très similaires aux savons pour créer des membranes biologiques. Il s’agit des phospholipides. Ce sont des molécules un peu plus complexes que les savons : elles possèdent deus queues hydrophobes et une tête hydrophile. Les membranes biologiques délimitent les cellules ainsi que les différents compartiments intracellulaires. Elles sont fondamentales pour la vie car elles permettent d’isoler différents compartiments dans lesquels se produisent des réactions chimiques très variées.
Les phospholipides constituent la charpente des membranes biologiques. Dans ces structures, ils sont associés en bicouche, de façon à exposer uniquement les têtes hydrophiles à l’eau en accolant leurs queues hydrophobes au milieu de ce qui forme la membrane.
Les molécules amphiphiles dont font partie les savons forment en quelque sorte des ponts entre deux milieux qui se repoussent. Ils permettent, par les interactions qu’ils entretiennent entre eux ou avec le milieu, de changer profondément les propriétés de celui-ci. C’est ainsi que l’homme a su transformer l’eau en un agent nettoyant efficace.
Modifié le: lundi 25 juillet 2016, 12:40