Etude des acides forts et des bases fortes dans l'eau(cours)
Cours : ACIDES FORTS et BASES FORTES.
Réaction acide fort/base forte
Objectifs:
-Définir un acide fort, une base forte et étudier quantitativement la transformation chimique de l’un avec l’autre.
Un petit logiciel « dosaexe » permet de simuler les expériences et donner les valeurs du pH quand on ne dispose pas de pHmètre.
Connaissances requises :
-Définition du pH, autoprotolyse de l’eau, produit ionique de l’eau :[H3O+].[OH- ]=KE.
-Solutions acides et basiques.
-Quelques notions sur l’électronégativité des éléments.
Remarque :
Le symbole « n » désigne toujours une quantité de matière exprimée en moles (abréviation « mol »). On peut éventuellement tolérer de désigner « n » par « nombre de moles de.. », bien que cela revienne à confondre la grandeur et l’unité.
Rappel :
Définition de la concentration d’une solution:
C’est la quantité de matière de soluté introduite par litre de solution aqueuse finale sans préjuger de la conséquence de cette introduction (réaction totale, partielle ou nulle avec le solvant).
Remarque :
Pour éviter toute confusion, celle-ci est symbolisée par le lettre « c » ; la notation en double crochets « [] » est réservée à la concentration d’une espèce chimique particulière dans la solution.
I-REACTION DU CHLORURE D’HYDROGENE AVEC L’EAU :
1-Préparation d’une solution de chlorure d’hydrogène :
a-Préparation du gaz chlorure d’hydrogène (HCl) :
C’est réalisable par réaction entre l’acide sulfurique et le chlorure de sodium. Le gaz HCl (chlorure d’hydrogène) plus dense que l’air (*) tombe dans le ballon et chasse l’air. Un papier pH vire au rouge lorsque le ballon est rempli. (voir la figure ci-dessous)
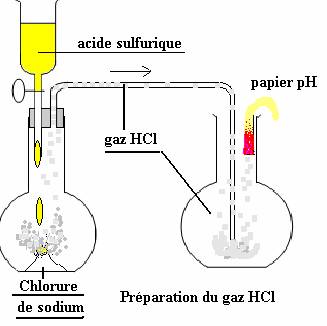
(*) Sa densité : d=M/29 =36,5/29 est largement supérieure à l’unité
b- Réaction du gaz HCl avec l’eau : préparation de « l’acide chlorhydrique » :
-Expériences :
Préparer un bouchon traversé par un tube de dégagement effilé à son extrémité inférieure. Humidifier légèrement la base du bouchon (**) ; boucher l’autre extrémité du tube avec le doigt et insérer le bouchon en le tournant dans le col du ballon contenant le gaz HCl.(voir figure gauche ci-dessous).L’étanchéité entre le bouchon et le ballon doit être parfaite.
Retourner le ballon en maintenant le doigt pressé contre le tube. Plonger l’extrémité du tube avec le doigt dans l’eau savonneuse d’un cristallisoir colorée avec un indicateur (BBT).
Retirer le doigt. L’eau du cristallisoir remonte dans le tube et pénètre dans le ballon en formant un petit jet d’eau !
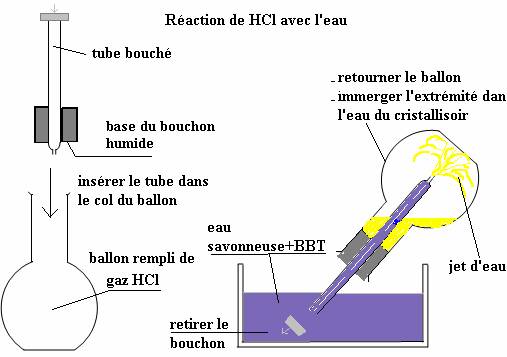
L’eau du cristallisoir en pénétrant dans le ballon vire au jaune indiquant qu’elle devient acide
Préparons deux tubes essai comme indiqué ci-dessous et ajoutons dans chaque une même quantité de nitrate d’argent.
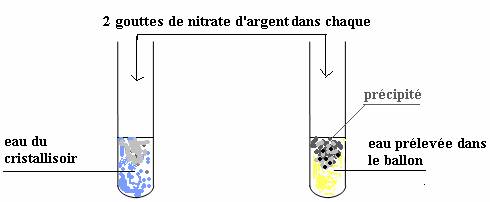
Interprétation :
L’aspiration est due à une dépression qui apparaît dans le ballon suite à la disparition du gaz HCl qui réagit avec l’eau.(**) Les traces d’eau suffisent pour déclencher la réaction .
La dissociation de molécule HCl est facilitée par la différence d’électronégativité entre les atomes d’hydrogène et de chlore. Les molécules d’eau polaires favorisent la rupture ionisante de la liaison entre les deux atomes. Le chlore très électronégatif emporte le doublet d’électrons. Le proton H+ restant est attiré par l’un des doublets non liants de l’oxygène. Une liaison H-O – s’établit avec une molécule d’eau qui devient un ion hydronium H3O+ .
.
Le précipité abondant qui se forme dans l’eau du ballon atteste bien la formation d’ions chlorure Cl-.
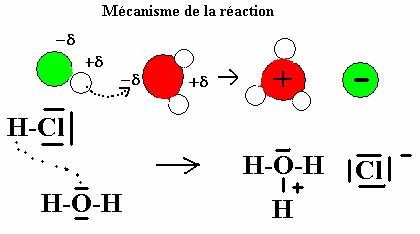
Voir :Animation mécanisme de réaction HCl +H2O (diaporama)
2-Mesures du pH de solutions de chlorure d’hydrogène de différentes concentrations
a/mesures :
|
|||||||||||||||
Pour d’autres concentrations, on trouvera les valeurs du pH obtenues sur le graphe ci-dessous
Pour tracer ce graphe, cliquer sur le lien : Logiciel de tracé des courbes de pH
Et sélectionner : simulation/définir le système/coupleH3O+/H2O/dilution/OK
Ce logiciel permet de tracer la courbe de variation du pH en fonction du cologarithme décimal de la concentration c de la solution, soit : pH=f(-log cA.). Il faut définir définir au départ le domaine de variation de cA.
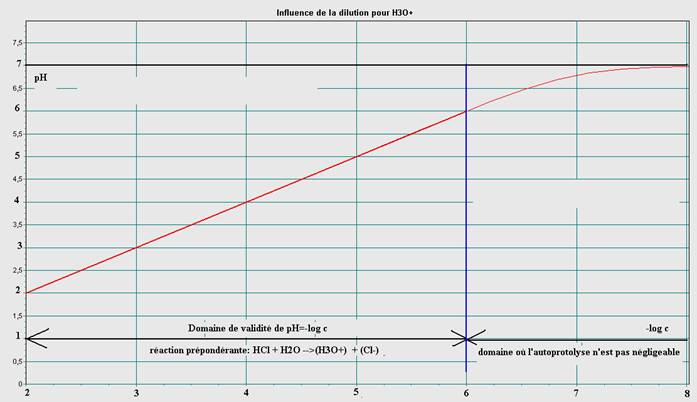
La courbe est une droite de pente égale à 1 dans un certain domaine
Ainsi, les mesures et le graphe montrent que :
pH=-log cA tant que cA>=10-6 mol.L-1.
b-Interprétons ces résultats :
L’introduction de HCl dans l’eau rend la solution acide. Cela signifie que lors de cette introduction, la concentration en ion hydronium [H3O+] augmente (et que par conséquent celle en HO- diminue puisque le produit [H3O+].[HO-] est constant.)
Ecrivons les équations des réactions chimiques à considérer
(1) H2O +H2O= H3O+ + HO- (équilibre d’autoprotolyse de l’eau)
(2) HCl + H2O --> H3O+ + Cl ( réaction de dissociation de l’acide HCl dans l’eau)
a/ pour 10-2<cA<10-6
Le pH de l’eau avant introduction de l’acide est voisin de 7 .La solution est neutre.
Après introduction du gaz HCl, le pH de la solution baisse de façon notable.
De pH= -log[H3O+] soit -log cA.=-log[H3O+], on tire [H3O+]=CA.
En quantité de matière:
nH3O+(sol)= nHCl (apportée)
Par exemple :pour CA=10-2 moL.L-1, pH=2,0 et donc [H3O+]= 1,0.10-2 mol.L-1.=CA
Ce qui signifie que tous les ions H3O+ de la solution proviennent des molécules HCl apportées dans la solution , la réaction est dite totale et l’acide HCL est dit « fort ».
La réaction d’autoprotolyse de l’eau (1) est négligeable dans ce cas.
b/ cA<10-6 :
Les deux réactions (1) et (2) sont à prendre en compte pour le calcul du pH.
Pour une dilution infinie le pH devient celui de l’eau ! Il tend donc vers 7.
La courbe ci-dessus tend vers une limite.
La relation pH=-logcA n’est bien entendu plus applicable !
II-Réaction de l’hydroxyde de sodium avec l’eau :
1- préparation d’une solution de soude :
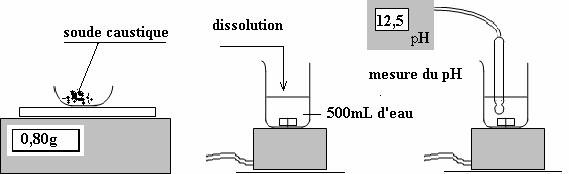
La solution obtenue est nettement basique, des ions hydroxydes sont libérés dans la solution.
L’équation de dissolution s’écrit :
NaOH(s)à Na+(aq) + Cl-(aq)
2-mesures du pH de solutions de soude de diverses concentrations:
|
|||||||||||||||
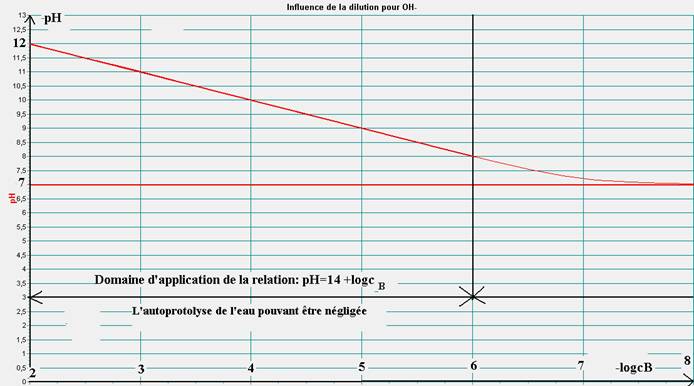
La courbe pH=f(-logcB) est une droite de pente -1 et d’ordonnée à l’origine 14. La relation s’écrit, dans le domaine linéaire :
pH=14 + logcB tant que cb>=10-6 mol.L-1.
3 -interprétation :
Les solutions d’hydroxyde de sodium sont basiques.
La dissolution de la soude dans l’eau s’écrit :
NaOH(s) à Na+aq + HO-aq. (1)
Le produit ionique de l’eau : [H3O+].[HO-]= KE =10-14 à 25°C permet de donner une définition équivalente du pH : pH=-log[H3O+] = 14 + log[HO-] (valable à 25°C)
On déduit ainsi des mesures que :
[HO-]=cB.
Ce qui signifie que la transformation (1) est totale .Pour cela on qualifie l’hydroxyde de sodium de base forte.
La relation encadrée n’est bien sûr plus applicable pour des solutions très diluées (cB<=10-6).
Dans ce dernier cas, il faut prendre en compte l’autoprotolyse de l’eau pour évaluer le pH.
Pour une dilution infinie, le pH est celui de l’eau ! Le pH ne peut descendre en dessous de 7 !
La relation encadrée ci-dessus est donc à utiliser avec précaution !
III- REACTION ACIDE FORT/BASE FORTE :
a- manipulation (voir montage ci-dessous) :
Préparons par exemple vA=10,0ml d’une solution de chlorure d’hydrogène de concentration cA =1,0.10-1mol.L-1 dans un bécher de 100ml.
Versons ml par ml une solution d’hydroxyde de sodium Na+ + HO- de concentration cB =1,0.10-1 mol.L-1 et notons à chaque fois le pH de la solution après homogénéisation.
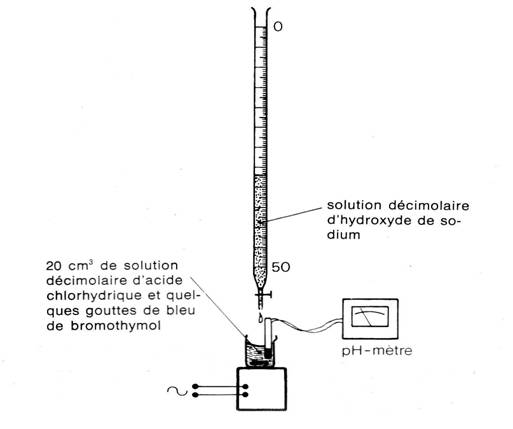
b-résultats (tracé de la courbe pH=f(vB) avec le logiciel « dosaexe »et détermination de l’équivalence par la « méthode des tangentes parallèles »
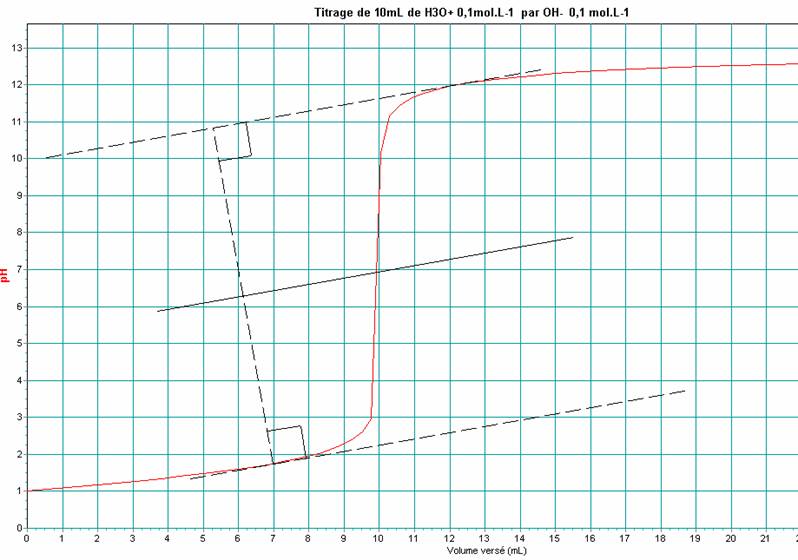
c-interprétation :
L’allure de la courbe résulte nécessairement d’une transformation chimique entre les espèces
chimiques H3O+ présentes dans la solution acide et OH- apportées par la solution d’hydroxyde de sodium (nous admettrons que les espèces Cl- et Na+ ne réagissent pas).
Une simple dilution des espèces lors de l’ajout de la solution d’hydroxyde de sodium ferait augmenter légèrement le pH qui resterait acide.
Or, nous voyons que le pH dépasse la valeur 7, cela ne peut se produire que si les ions H3O+ disparaissent complètement, car les ions hydronium sont très minoritaires en milieu basique
La courbe présente un saut de pH vers vB=10mL. Pour cette valeur de vB=vbE(point d’équivalence), la courbe pH=-log[H3O+] augmente très brutalement ce qui n’est possible que si [H3O+] décroît très fortement.
1-Montrons que la réaction est totale :
L’équation à prendre en compte est la réaction acide base (écrite dans le tableau ci-dessous)
Il est commode de réaliser un tableau d’avancement pour un mélange particulier, par exemple 10mL de solution acide et 5,0mL solution d’hydroxyde de sodium versé.
Soit x la quantité de matière définissant l’avancement :
|
|||||||||||||||||||
L’avancement maximum xm est celui pour lequel la réaction serait totale. (Ce qui n’est pas forcément le cas en général). Cela signifie alors que le réactif limitant (ou en défaut : ici HO-) a complètement disparu,( ou les deux réactifs ont disparu si le mélange est dans les proportions stoechiométriques ce qui n’est pas le cas dans notre exemple):
Soit : 0.5-xm=0 et donc xm=0,5mmoL. Il resterait alors : 1-xm=0,5mmoL de H3O+ qui est ici en excés.
Revenons à l’avancement à l’état final xF.
De pH égal à environ 1,5, lu sur la courbe, nous en déduisons :[H3O+]=10-pH=10-1.5 =0.032mol.L-1.
Soit nH3O+ restant= 0.032.(15)=0.48mmoL#0.50mmoL.
Donc : (1-xF)=0.5mmoL et donc xF =0,5mmoL=xm ce qui confirme que la réaction est totale.
Ce raisonnement est applicable tant que : 0<vB<10mL.
2-Etude de l’équivalence :
Définition générale : L’équivalence est obtenue lorsque les quantités de réactifs sont mélangées dans les proportions stoechiométriques de l’équation de la réaction.
C'est-à-dire quand nHO-= 1,0mmoL. Soit cBvB= 1,0 mmol et Vb=10,0mL.
La réaction étant totale on pourrait penser que tous les ions H3O+ du départ ont réagi avec tous les ions HO- versés ,ce qui est quasiment vrai !.Sauf que la réaction donne de l’eau et que l’eau apporte des ions H3O+ et HO- par l’autoprotolyse en quantité infime!
A l’équivalence on a donc : [H3O+]=[OH-] =10-7 mol.L-1.et donc pH =7.
Si les concentrations précédentes ne sont pas absolument nulles cela résulte de l’existence de l’autoprotolyse de l’eau qui n’est autre que la réaction inverse de la réaction acide fort/base forte. Les deux réactions inverses l’une de l’autre constituent un équilibre chimique.
Il faut encore préciser que les ions sodium et chlorure ne réagissent pas avec l’eau et que la neutralité (pH=7) est bien maintenue malgré leur présence.
Détermination expérimentale de l’équivalence :
Cette détermination est nécessaire pour réaliser un dosage.
Au point d’équivalence, la pente de la courbe est maximum .Cette propriété peut être mise à profit pour sa détermination.
a-A partir de la courbe : 2 méthodes sont possibles : méthodes des tangentes et celle de la dérivée :ces dernières sont utilisées dans le logiciel « dosaexe ».
b-utilisation d’un indicateur coloré adapté : il faut choisir l’indicateur dont la zone de virage inclus la valeur du pH à l’équivalence. Dans le cas de la réaction acide fort/base forte c’est le BBT (bleu de bromothymol) qui est le mieux adapté.
3-La courbe au-delà de l’équivalence :
Les HO- ajoutés sont alors en excès .Ces derniers sont dilués dans la solution.
Le pH est celui d’une solution diluée d’hydroxyde de sodium.