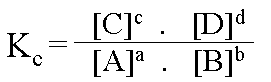Complément sur les équilibres chimiques
URL source du document
Équilibre chimique
I. Réactions complètes, équilibrées et incomplètes.
R. complète : se déroule jusqu'à épuisement d'un réactif au moins.
|
|
2 HCl + Ca(OH)2
|
. début : |
0,5 0,8
|
. fin : |
0 0,8-0,25 = 0,55
|
|
|
|
. début : |
0,5 0,25
|
. fin : |
0 0
|
R. impossible : aucune transformation n'est observée lorsqu'on met les réactifs en présence.
Au + H2O 
R. équilibrée : dans cette réaction, on observe une transformation, mais aucun des réactifs ne sera épuisé totalement.
|
|
N2 + 3 H2
|
. début : |
0,8 0,4
|
. équilibre : |
0,8 - x 0,4 -3x
|
 Le coefficient de x est déterminé par le coefficient de la molécule à laquelle il se rapporte, lorsque l'équation est pondérée.
Le coefficient de x est déterminé par le coefficient de la molécule à laquelle il se rapporte, lorsque l'équation est pondérée.
II. Mise en évidence d'une réaction incomplète.
|
|
Les solutions contenues dans les berlins ci-contre ont la même concentration molaire, (). La solution incolore est une solution de KSCN La solution orangée/jaune est une solution de FeCl3 |
Mettons maintenant à l'aide d'une pipette jaugée la même quantité de réactifs dans une éprouvette contenant de l'eau distillée et observons, nous observons un changement de couleur, ce qui indique qu'une réaction s'est opérée. Redistribuons maintenant le contenu de ce berlin dans 3 petits berlins. Dans l'un rajoutons du KSCN, dans un autre, rajoutons du FeCl3 et observons par-rapport au témoin les changements éventuels. |
|
|
|
|
|
|
En rajoutant du KSCN, l'on observe que la couleur devient plus intense, il y a donc encore réaction. |
En rajoutant du FeCl3, l'on observe que la couleur devient plus intense, il y a donc encore réaction. |
Berlin témoin dans lequel rien n'a été rajouté; |
(*) les couleurs ne correspondent pas exactement à la réalité.
Si lorsque l'on rajoute l'un ou l'autre des deux réactifs de départ, la coloration change, c'est qu'il reste encore de l'autre réactif dans la solution. Ce qui signifie que dans une réaction incomplète aucun des réactifs n'est épuisé totalement.
 voici comment se note la réaction : FeCl3 + KSCN
voici comment se note la réaction : FeCl3 + KSCN 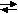 FeSCN2+ + KCl + 2Cl-
FeSCN2+ + KCl + 2Cl-
III. Etat d'équilibre et réaction incomplète.
Dans un système chimique à l'état d'équilibre, deux réactions inverses à vitesse égale se déroulent. Ce système chimique est dit alors système à l'état d'équilibre dynamique. Exemple : dans la réaction décrite ci-dessus pendant qu'une partie des réactifs deviennent FeScN2+ + KCl + 2 Cl-, une autre réaction s'effectue au niveau des produits, ceux-ci redeviennent du FeCl3 + KScN, les deux réactions se produisent à la même vitesse, il nous semble alors que plus aucune réaction ne se fait car il n'y a pas de changement visible à l'œil nu.
Conditions d'équilibre :
- Il faut qu'il n'y aie plus de changement visible à l'œil nu.
- Il faut que le système soit isolé.
- Il faut que 2 réactions inverses simultanées se produisent, une réaction directe qui transforme les réactifs en produits (vert) et une réaction inverse qui transforme les produits en réactifs (rouge).
IV. Aspect quantitatif de l'équilibre.
a. notations : |
une concentration de départ (initiale) se note : CA = 0,1 mole/L |
|
|
la concentration à l'équilibre se note : [ A ] et [A] < 0,1 mole/L |
b. Loi de Guldberg - Waage :
La formule de la constante d'équilibre a pu être mise en évidence sur base de résultats expérimentaux.
a.A + b.B
|
|
| A,B = réactifs | a,b,c,d : coefficients stœchiométriques. |
|
C,D = produits |
|
Kc = notation de la constante d'équilibre exprimée en fonction des concentrations.
|
|
Si Kc est grand 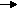 on tend vers la réaction complète.
on tend vers la réaction complète.
Si Kc est très petit 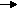 on tend vers une réaction impossible.
on tend vers une réaction impossible.
 Dans l'expression de Kc, on ne fait pas figurer les solides, on remplace les concentrations des solides par le chiffre [1].
Dans l'expression de Kc, on ne fait pas figurer les solides, on remplace les concentrations des solides par le chiffre [1].
Exemple : Expression de la constante d'équilibre de 2 Li+(aq) + CO32-(aq) 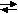 Li2CO3 (s)
Li2CO3 (s)
Modifié le: Monday 25 July 2016, 12:51


 *
* *
*