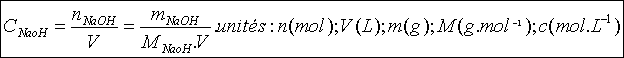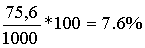TP2.Utilisation du jus de chou rouge comme indicateur coloré
TP2-Utilisation du jus de chou rouge comme indicateur de pH
I-dosage d’un vinaigre :
L’étiquette collée sur la bouteille indique « 8 degrés ». Ce chiffre représente un pourcentage massique.
Cela signifie que pour 100 grammes de solution de vinaigre, celle-ci contient 8 grammes d’acide éthanoïque.
Nous allons réaliser un dosage pour vérifier ce chiffre
A-Protocole expérimental :
a-Dilution de la solution de vinaigre à doser :
Pour éviter de gaspiller le vinaigre, nous allons préparer une solution diluée de vinaigre au 1/10ème.
Pour cela, il suffit de prélever 1 part de vinaigre que l’on verse dans un récipient et d’y ajouter 9 parts d’eau. Ainsi prélevons 1,0mL de vinaigre avec une petite seringue de capacité 2mL. Versons le contenu dans un pot de yaourt .Rinçons la seringue et ajoutons dans le pot 4 fois 2,0mL + 1fois 1,0mL=9,0mL d’eau distillée. Agiter doucement le pot avec la main pour homogénéiser.
Il est recommandé de préparer une deuxième solution identique pour pouvoir effectuer un premier dosage approché.
b-Préparation de la solution titrante :solution diluée de soude
Dans le commerce nous trouvons des solutions de soude à 30,5% de densité 1.1.
Préparons 100mL de solution diluée à partir de la solution commerciale diluée 100 fois.
Les volumes devant être mesurés avec précision, le récipient idéal pour préparer cette solution est la fiole jaugée de 100mL. Verser 1,0mL de soude commerciale dans la fiole et ajouter de l’eau jusqu’au trait. Homogénéiser la solution.
Calcul de la concentration molaire volumique de la solution commerciale:
Celui-ci s’effectue à partir des deux expressions suivantes :
*Concentration c de la solution commerciale :
*Pourcentage massique de la solution :
Appliquons ces relations pour 1 Litre de solution.
msolution= ..V=1,1g.mL*1000mL=1100g .
..V=1,1g.mL*1000mL=1100g .
mNaOH=0.305*1100=335g
La masse molaire moléculaire de NaOH est M=40g.mol-1.
La solution diluée au 1/100ème a donc une concentration cB=8,4 10-2 mol.L-1.
c-Dosage :
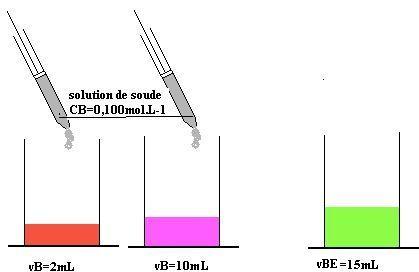
Dans le pot contenant la solution diluée 10 fois de vinaigre ajoutons quelques gouttes de l’indicateur coloré. La solution prend une teinte rouge (FIG ci-dessous).
Verser ensuite 0,5mL par 0.5mL avec une seringue la solution diluée de soude. Après chaque versement agiter le pot délicatement .La couleur se modifie progressivement preuve que le pH varie et qu’une réaction se produit. Mesurer le volume versé lorsque la solution vire au vert.
Refaire un dosage plus précis en ajoutant la solution goutte à goutte, jusqu’à obtenir la couleur vert pâle. Noter le volume VBE versé (FIG ci-dessous)
B-Interprétation :
L’ajout de soude dans le vinaigre déclenche la réaction :
CH3COOH + OH- à CH3COO- + H2O (pKA=4,8)
Lorsque la solution devient verte, le pH est de l’ordre de 8 ce qui correspond au point d’équivalence de la courbe acide faible/ base forte. Le passage au vert correspond au saut du pH, c’est pour cela qu’il faut verser l’indicateur goutte à goutte afin de ne pas dépasser l’équivalence
A l’équivalence, toutes les molécules CH3COOH initialement présentes sont transformées en CH3COO-.
Il y a alors égalité entre les quantités de matière :
Quantité d’acide initiale= quantité de soude versée
CA.VA=CB.VBE
Soit CA= 8,4.10-2.15/10=12,6.10-2 mol.L-1
La solution de vinaigre a donc une concentration de Co=10.CA=1,26mol.L-1.
1 litre de solution de vinaigre contient donc 1,26mol.L-1*60g.mol-1= 75.6g
La masse d’un litre de vinaigre étant de 1000g
Le pourcentage d’acide éthanoïque dans la solution est donc :
Ce chiffre est en accord avec l’inscription de l’étiquette.
II-Différentes formulations de l’aspirine, effet tampon :
a-présentation de l’aspirine :
L’aspirine est l’un des médicaments les plus vendus dans le monde. Il existe une multitude de formes à administrer par voie orale : comprimés simples, enrobés ou effervescents, poudres…
Dans tous les cas, la substance active est la même : c’est l’acide acétylsalicylique de formule CH3—CO2-C6H4-CO2H. (noté par la suite AH.).
Le pKA du couple HA/A- est 3,5 ce qui signifie que l’aspirine est un acide faible, plus fort cependant que l’acide éthanoïque (pKA=4,8).
La forme HA est très peu soluble dans l’eau alors que forme conjuguée A-(ion acétylsalicilate) est au contraire très soluble.
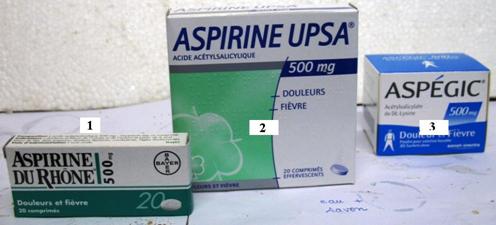
b-objectifs comparer 3 formulations du commerce et montrer l’intérêt de chacun d’eux
1-L’aspirine simple (sans autre ajout que l’enrobage) en comprimé « Usine du Rhône »
2-L’aspirine en cachets effervescents « Upsa » contient de l’hydrogénocarbonate de sodium H2CO3Na.
3-L’aspirine en poudre « Aspégic ». L’aspirine est associée à un acide aminé :la lysine
L’estimation du pH avec le jus de chou rouge permettra d’expliquer le rôle de ces substances.
c-expérience de comparaison et interprétations :
Préparons 3 flacons contenant de l’eau distillée et ajoutons y une dizaine de gouttes de chou rouge. Les solutions prennent une teinte violacée couleur naturelle du chou (FIG ci-dessous).
Réalisons la dissolution dans l’eau des 3 médicaments 1, 2 et 3 et observons (FIG ci-dessous).
1- La solution d’aspirine simple est nettement acide (pH voisin de 2) .Le trouble indique que la dissolution est très incomplète.
L’aspirine simple se dépose en plaques au fond du récipient. La forme acide du couple AH est donc peu soluble.
Parvenue dans l’estomac, milieu très acide, les dépôts hétérogènes de l’aspirine sur la paroi gastrique sont encore plus importants et déclenchent des irritations et un retard d’assimilation du médicament. Pour cette raison cette forme d’aspirine bien que bon marché est peu utilisée.
2-L’introduction du cachet s’accompagne du dégagement d’un gaz : c’est du dioxyde de carbone. La couleur de l’indicateur montre que le pH a augmenté jusque 5.5 environ.
Contrairement à l’aspirine simple, la dissolution de l’aspirine bien que lente est quasi complète ce qui facilite son assimilation par l’estomac.
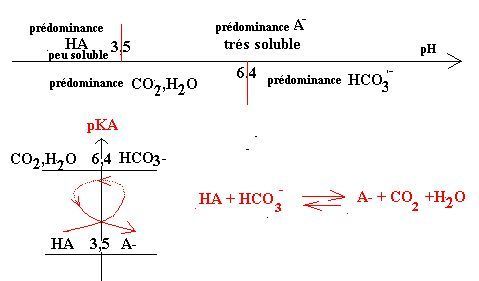
Pour interpréter ces observations il suffit de tracer les domaines de prédominance des différentes espèces suivant le pH.
Nous voyons sur ce diagramme qu’à pH=2, l’espèce qui prédomine est HA qui est peu soluble (cas de l’aspirine simple). Par contre à pH=5.5 c’est A- soluble qui prédomine.
Une réaction chimique s’est donc produite entre l’aspirine HA et les ions hydrogénocarbonate HCO3-.La réaction fournit A- et le gaz CO2.(réaction s’effectuant suivant la flèche )
(La réaction n’est cependant pas totale car l’écart entre les pkA des couples est inférieur à 4 unités)
Par cette réaction, HA peu soluble est quasi intégralement transformé en A- soluble.
La présence du couple CO2, H2O/HCO3- a pour effet de maintenir le pH à une valeur proche de la valeur du pKA de ce couple malgré l’ajout d’un acide HA. Le couple CO2, H2O/HCO3- crée un effet tampon dans la solution c'est-à-dire que l’ajout d’un acide ou d’une base modifie peu son pH. Pour cela, cette forme d’aspirine est appelée «aspirine tamponnée ».
3-« Aspégic » se dissout instantanément et le pH est proche de 6 .
Ce médicament contient de l’acétylsalicilate de lysine.
L’avantage d’aspégic par rapport au comprimé effervescent Upsa est la dissolution immédiate de l’apirine ce qui permet d’introduire éventuellement le médicament directement dans le sang.
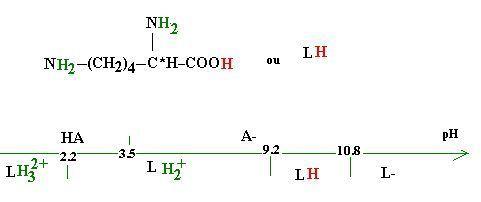
La lysine est un acide aminé de formule :
Suivant le pH la lysine possède 4 formes différentes (dans le sens décroissant du pH, le passage d’une forme à une autre résulte du gain de 1 H+).
A pH=6 c’est la forme LH2+ qui prédomine et qui impose le pH à la solution.
La lysine réalise un effet tampon qui permet la transformation de l’aspirine HA en A-.
A retenir : l’effet tampon,
Une solution est tamponnée si le pH varie peu lorsqu’on y ajoute une quantité limitée d’acide ou de base.
Le pH ne varie pas si l’on dilue la solution.
L’effet tampon est d’autant mieux marqué que le pH est proche du pKA du couple responsable de l’effet tampon.
Ex de solution tampon : solution à la demi- équivalence de la réaction acide faible base forte.
Modifié le: Thursday 4 August 2016, 15:39