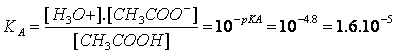Exercice bac:acide et bases en solution aqueuse
Exercice bac (TC) constante d’acidité

Correction
1-Concentration des espèces présentes :
La dissolution dans l’eau de l’acide est une réaction limitée:
CH3COOH + H2O <=> CH3COO- + H3O+ (équilibre de constante KA)
ainsi que l’autoprotolyse : H2O + H2O--H3O+ +OH-(équilibre de constante KE)
Posons : CH3COOH=A et CH3COO-=B
Calculons d’abord la concentration c de la solution :

Remarque : ne pas confondre « cA » et « [CH3COOH] » !
« CA » est la quantité d’acide apportée par litre sans préjuger de la réaction (ici limitée) de l’acide avec l’eau. Alors que [CH3COOH] est la concentration effective dans la solution compte tenu de la réaction. (Ces deux concentrations égales seulement si la réaction est totale)
De pH=2,9 on tire [H3O+] =10-2,9=1,26.10-3 mol.L-1.
Nous admettons que l’autoprotolyse est négligeable à cette concentration ;
dans ce cas les ions H3O+ proviennent exclusivement de la dissolution dans l’eau de l’acide et :[H3O+]=[B]=1,26.10-3 mol.L-1
[A]= c- [B]= 0,10-1,26.10-3= (100-1.26)*10-3=9,9*10-2(valeur très proche de 0,10mol.L-1).
La réaction est quasi nulle dans le sens direct et quasi-totale dans le sens inverse.
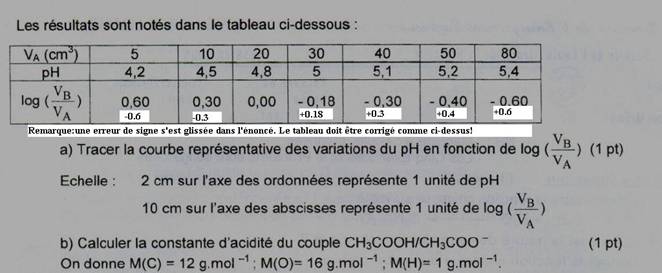
2-a .courbe:
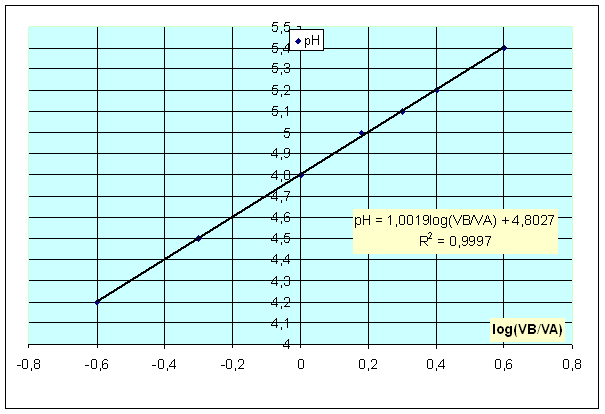
Le pH est donc une fonction affine croissance du log(VB/VA) de pente égale à1 et d’ordonnée à l’origine 4,8
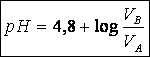
2-b calcul de la constante d’acidité :
Le calcul des concentrations des espèces B et A dans les différents mélanges est réalisé en considérant que celles-ci subissent une simple dilution comme si ces espèces étaient inertes (comme Cl- ou Na+).
C'est-à-dire que l’on néglige le déplacement de l’équilibre
CH3COOH + H2O <=> CH3COO- + H3O+ lors de l’ajout d’eau.
(la justification de cette approximation n’est pas demandée).
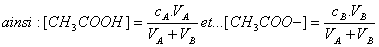
Et comme CA=CB
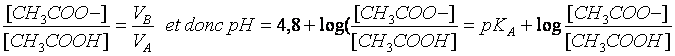
En posant pH=-log[H3O+] et pKA=-log KA (ou KA=10-pKA)
On obtient :