|
Notions et contenus
|
Activités envisageables
|
Connaissances et savoir-faire exigibles
|
|
Les eaux de source.
Composition chimique d'une eau minérale ; diversité.
Dureté d'une eau et conséquences.
Limites : l'écriture des réactions chimiques mises en jeu dans les
dosages n'est pas une compétence exigible. La notion de mole n'est pas
nécessaire.
|
- Tests gustatifs comparés sur des eaux de consommation.
Approche du T°H par action comparative d'une solution savonneuse (dans
l'alcool).
- Mesure du pH.
Dosage des ions chlorure ou des ions hydrogénocarbonate.
|
- Connaître les ions responsables de la dureté de l'eau
(ions calcium et magnésium).
- Connaître quelques conséquences de la dureté de l'eau.
- Dégager les notions d'acidité et de basicité de la mesure du pH.
Utiliser des résultats expérimentaux pour comparer différentes eaux.
|
Préparation d'une
solution hydrotimétrique au laboratoire
Découper 25 g de savon de Marseille sec en
fines lamellesL Le placer dans un ballon de 1 litre avec 400 mL d'alcool de
Gay-Lussac dont le bouchon est traversé par un tube de verre de 1 m de long.
(Ce tube sert à condenser les vapeurs d'alcool).
Chauffer le ballon qu bain-marie jusqu'à ce que
le savon soit dissous et ajouter 250 mL d'eau distillée.On obttient une liqueur
titrée de savon.
En vieillissant, la liqueur tend à laisser
déposer le savon. Agiter fortement le savon avant emploi. S'il reste des
grumeaux, réchauffer la liqueur au bain-marie.
Protocole sur la dureté
des eaux
Les eaux naturelles peuvent être plus ou moins riches en ions calcium et
magnésium, ce qui caractérise leur dureté. On compare qualitativement la dureté
de différentes eaux.
Principe de la méthode :
En présence de savon, plus une eau mousse, plus elle est douce ; moins
elle mousse, plus elle est dure.
A partir d'une solution alcoolique de savon de Marseille préparée au
laboratoire, appelée solution hydrotimétrique, on peut faire mousser plusieurs
eaux de provenances différentes, en prenant comme témoin de l'eau distillée.
Mode opératoire :
* Verser dans différents tubes à essais numérotés, à l’aide d’une burette
graduée, 2mL de chacune des eaux à étudier.
* Ajouter 3 gouttes de solution hydrotimétrique dans chaque tube. Agiter
énergiquement 5 fois chaque tube et laisser reposer jusqu’à ce que la mousse
retombe. Tube après tube continuer l'addition de solution hydrotimétrique (au
maximum 3 gouttes à chaque fois) jusqu'à obtention d'une mousse persistante sur
1 cm de hauteur après agitation.
* Compter le nombre total de gouttes ajoutées et récapituler les résultats
dans le tableau suivant :
|
nature de l'eau
|
eau du robinet
|
Source Blanche
|
Contrex
|
Badoit
|
Vichy Célestin
|
Amanda
|
|
nombre de gouttes
|
|
|
|
|
|
|
Exploitation des résultats :
Utiliser les résultats de ce tableau pour classer ces eaux par ordre de
dureté croissant.
Protocole sur le dosage
des ions chlorure
Principe du dosage par précipitation :
Les dosages par précipitation mettent en présence deux solutions, qui, en se
combinant, donnent un sel insoluble qui précipite.
Quelques gouttes de solution de nitrate d'argent ajoutées à 1 mL de solution
de chlorure de sodium dans un tube à essais donnent un précipité blanc de
chlorure d’argent. (Expérience du professeur)
On dose l’eau minérale avec une solution de nitrate d'argent en présence
d’une solution d'ions chromate CrO42- comme indicateurs
de fin de réaction.
Le nitrate d'argent se combine tout d'abord au chlorure de potassium. Quand
il ne reste plus de chlorure de potassium, la première goutte de nitrate
d'argent en excès se combine alors avec le chromate de potassium pour donner un
chromate d'argent qui formera un louche rouge persistant.
Le principe de ce dosage se vérifie en ajoutant à 1 mL de solution de
chlorure de sodium additionnée de 3 gouttes de chromate de sodium, un peu de
solution de nitrate d'argent pour obtenir les changements voulus. (Expérience
du professeur)
Mode opératoire :
* Verser dans un bécher à l’aide d’une pipette jaugée, 5 mL d'eau à tester.
* Ajouter 4 à 5 gouttes de solution de chromate de potassium et homogénéiser
le milieu réactionnel.
* Ajouter goutte à goutte la solution de nitrate d’argent jusqu’à la
formation d’un louche rouge persistant
* Compter le nombre total de gouttes ajoutées et récapituler les résultats
dans le tableau suivant :
|
nature de l'eau
|
eau du robinet
|
Source Blanche
|
Contrex
|
Badoit
|
Vichy Célestin
|
Amanda
|
|
tCl- en mg.L-1
|
|
14
|
8,6
|
40
|
235
|
66
|
|
nombre de gouttes
|
|
|
|
|
|
|
Exploitation des résultats :
Utiliser les résultats de ce tableau pour construire le graphe de la
concentration massique (ou titre) en ion chlorure en fonction du nombre de
gouttes de solution de nitrate d’argent ajouté. En déduire le titre en ions Cl-
de l’eau du robinet.
Des eaux naturelles à l'eau potable
|
Notions et contenus
|
Activités envisageables
|
Connaissances et savoir-faire exigibles
|
|
- Le cycle de l'eau dans la nature ; enjeux planétaires.
- Critères physicochimiques de potabilité.
- Opérations de traitement d'une eau naturelle : purification.
|
- Visite d'une station captation / purification.
- Réalisation d'une ou plusieurs opérations de purification : décantation,
filtration, floculation, action du carbone actif, distillation d'une eau
salée, traitement par résine échangeuse d'ions.
|
- Reconnaître les différents changements d'état
intervenant dans le cycle de l'eau.
- Utiliser les termes décantation, filtration, distillation.
- Identifier des techniques de séparation utilisées dans le cas d'exemples
proposés.
- Repérer, dans un document différents agents responsables de la pollution
de l'eau.
|
Réalisation d'une station
de traitement des eaux de surface
Quelques définitions :
Le dégrillage et le tamisage permettent de retenir les corps
flottants et les gros déchets.
La filtration sur sable retient les dernières particules ; la filtration
sur charbon actif certains corps dissous et élimine les mauvaises odeurs.
La floculation provoque la coagulation des particules en gros flocons
qui se déposent par décantation.
- Proposer un ordre
des opérations à effectuer pour le traitement d’une eau de surface.
Protocoles
expérimentaux :
|
A chaque opération, garder un échantillon de l’eau traitée
dans un tube à essais, afin de pouvoir les comparer. (limpidité, pureté…)
|
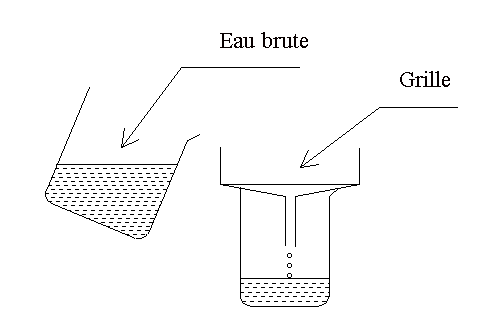
|
|
* Verser de l’eau brute dans un
entonnoir recouvert d’une grille.
Observation 1.
* Verser
dans le bécher 3 mL d’eau de chaux pour neutraliser l’eau et ajouter 6 mL de
solution de sulfate d’aluminium. Observation 2.
* Réaliser la
filtration sur sable. Observation 3.
* Ajouter une spatule de
charbon actif au filtrat, agiter puis filtrer de nouveau sur papier filtre.
Observation 4.
|
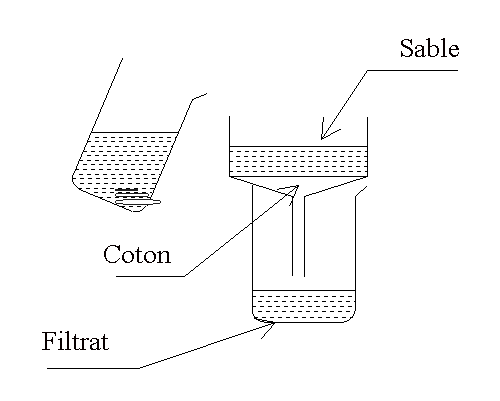
|
Analyse de l'eau obtenue après
traitement
Test de pureté :
* Verser dans un tube à essais2
mL de cette eau. Ajouter quelques gouttes de nitrate d’argent. Observation
5.
Minéralisation
totale :
* Prendre 2 mL d’eau dans un tube à
essais et porter à ébullition douce jusqu'à évaporation totale.
L’expérience est répétée avec les eaux minérales étudiées de telle sorte à
comparer les résidus et à classer l’eau traitée.
2) Proposer un classement des eaux en fonction de l’importance du résidu.
Sur les étiquettes d’eaux minérales on peut lire la minéralisation totale
(ou résidu sec). C’est la masse de solide restante après évaporation d’un litre
d’eau.
3) Se reporter à l’activité 1 pour établir le classement des eaux
étudiées en vue de les comparer.
Les oligoéléments
|
Notions et contenus
|
Activités envisageables
|
Connaissances et savoir-faire exigibles
|
|
- Les oligoéléments : présentation, ordre de grandeur des teneurs en
minéraux, sources, rôle, apports nécessaires ; différence entre
"oligoélément" et "macroélément".
Limites
L'étude des macroéléments (Na, K,Ca, Mg et P) n'est pas envisagée.
|
-Mise en évidence par un test chimique sur un extrait
naturel des oligoéléments présents dans un aliment (ou sur un complémént
alimentaire commercial).
-Dosage du fer dans le vin, dans les épinards (au choix).
- Activité documentaire pour les autres éléments : sources, besoins,
quantités, rôle.
|
- Dégager, dans un document, les sources, le rôle et
les apports nécessaires en oligoéléments.
|
Le Grand Larousse Universel (éd. 1989, p. 7565) en
donne la définition suivante:
Élément métallique ou non
métallique qui ne présente qu'un pourcentage infime des constituants des êtres
vivants, et dont la présence à l'état de traces est cependant nécessaire à la
croissance ou à la vie des animaux et des végétaux.
Thérapeutique : certains
oligoéléments ont un rôle important dans le métabolisme cellulaire et leur
carence alimentaire peut être responsable de troubles sévères.
Préparation des solutions
étalons pour le dosage de l'élément fer par colorimétrie
Celles- ci sont prépérées au laboratoire
Dosage de l'élément fer dans
un vin par colorimétrie :
Traitement de l’échantillon de vin :
Décoloration :
- Verser dans un
bécher de 100 mL environ 30 mL du vin à décolorer.
- Ajouter une spatule
de noir de carbone et bien agiter pendant quelques minutes.
- Filtrer, sur deux
épaisseurs de papier filtre, au dessus d’un récipient préalablement
rincé. Si le filtrat n’est pas incolore, recommencer la filtration.
Oxydation des ions fer (II) :
L’élément fer se trouve dans le vin sous forme d’ions Fe2+ et Fe3+
et on veut connaître sa concentration totale. On réalise donc, après avoir
décoloré le vin, l’oxydation des ions fer (II) en ions fer (III) par action de
l’eau oxygénée en milieu acide.
- Prélever 10 mL du vin
préalablement décoloré et les verser dans un tube à essais.
- Ajouter 1,0 mL de
solution d’acide chlorhydrique à 6 mol.L-1.
- Ajouter 5 gouttes
d’eau oxygénée à 20 volumes.
Complexation des ions fer (III) :
Les ions Fe3+ sont ensuite révélés par une solution de
thiocyanate de potassium K+ + SCN-. Il se forme un ion
complexe.
- Dans le tube
précédent, ajouter 1 mL de solution de thiocyanate de potassium.
Réserver le tube pour le dosage ultérieur.
Dosage par colorimétrie :
Deux solutions, contenant la même substance colorante et observées dans les
mêmes conditions, ont la même coloration si elles ont la même concentration en
substance colorante.
Un dosage colorimétrique ou par comparaison à l’oeil nu nécessite une
échelle de teintes avec des tubes étalons. La concentration en élément fer de
l’échantillon est proche de celle du tube étalon le plus semblable.
·
Numéroter 8 tubes à essais et verser dans chaque
tube environ 1/3 d’une solution étalon
·
Comparer la coloration de la solution de vin à
doser.
Donner un encadrement de la
concentration massique en élément fer mesurée par cette méthode.
Dosage de l'élément fer dans
un vin par spectrophotométrie (vérification)
A l’aide du spectrophotomètre :
Un spectrophotomètre mesure la quantité de lumière absorbée par une
substance colorée. Cette grandeur A est appelée absorbance. Pour une longueur
d’onde donnée (l = 480 nm), A est
proportionnelle à la concentration de la substance.
Remplir aux ¾ la cuve avec l’échantillon de vin traité solution de vin et mesurer leur
absorbance. (noter sa valeur).
Questions :
Absorbance des solutions étalons :
|
Titre de la solution en ions fer (III ) en mg.L-1
|
2
|
4
|
6
|
8
|
10
|
12
|
14
|
16
|
|
Absorbance
|
0,12
|
0,15
|
0,19
|
0,26
|
0,31
|
0,37
|
0,42
|
0,47
|
Construire le graphe représentatif A = f(t) de
l’absorbance en fonction du titre.
Déterminer graphiquement la concentration
massique en élément fer de ce vin.
Si la teneur du vin en élément fer est trop élevée, les cations fer peuvent
réagir avec les ions phosphate éventuellement présents ou avec les tanins pour
former un trouble : la " casse ferrique ". On
considère qu’au dessus de 15 mg.L-1 de la teneur en fer, la casse
ferrique devient probable.
Que penser du vin étudié ?
Les glucides
|
Notions et contenus
|
Activités envisageables
|
Connaissances et savoir-faire exigibles
|
|
Hydrolyse, réaction de polycondensation de l'amidon, macromolécules, tests
de l'amidon et du glucose. Les principales étapes de la panification.
On se limitera à la présentation de l'amidon, du glucose, du
saccharose et du fructose.
|
- Quelques réactions autour de l'amidon et du glucose.
- Mise en évidence de l'amidon et du glucose dans un aliment ; tests.
- hydrolyse acide (voie chimique ou enzymatique) de l'amidon (ou du
saccharose) ; mise en évidence des produits.
- Polycondensation de l'amidon.
- Application à la compréhension de la fabrication du pain.
|
- Connaître l'existence des sucres : glucose, fructose,
saccharose.
- Identifier l'amidon et le glucose à partir de résultats d'expériences.
- Reconnaître une réqction d'hydrolyse ou de polycon- densation à partir
d'un exemple concret.
|
Mise en évidence de
l'amidon dans certains glucides
Test de l’amidon :
·
Déposer un peu de poudre d'amidon dans une
coupelle et ajouter quelques gouttes d'eau iodée à l'aide d'une pipette à
doigt.
·
Recommencer la même expérience avec le glucose
Schématiser l’expérience et décrire le test caractéristique de
l'amidon.
Test du glucose :
·
Dissoudre une petite spatule du glucose en
poudre dans un tube à essais contenant un quart d'eau distillée et ajouter
quelques gouttes de liqueur de Fehling (chauffer en évitant les projections).
·
Recommencer la même expérience avec de l’empois
d’amidon.
Schématiser l'expérience et décrire le test caractéristique du glucose.
Recherche de ces glucides dans un aliment :
On dispose de pain, de farine et d’un jus de sirop de menthe .
·
Placer de la mie de pain ou un peu de poudre ou
de jus dans un tube à essais et ajouter de l’eau distillée (1/3 de tube).
·
Partager la phase liquide en deux et réaliser
les tests pour mettre en évidence la présence des deux glucides précédents.
Rassembler les résultats dans le tableau suivant et conclure sur la
présence des glucides.
|
Aliment
|
Test de l’amidon
|
Test du glucose
|
|
Pain
|
|
|
|
Farine
|
|
|
|
Sirop de menthe
|
|
|
Hydrolyse de l'amidon
Protocole expérimental :
·
Préparer 5 tubes à essais numérotés contenant
environ 5 mL d’empois d’amidon et 5 gouttes d’acide chlorhydrique concentré.
|
Tubes à essais
|
Tube 1
|
Tube 2
|
Tube 3
|
Tube 4
|
Tube 5
|
|
T °C
|
20
|
100
|
100
|
100
|
100
|
|
Temps de réaction (min)
|
0
|
5
|
10
|
15
|
20
|
|
Réaction à l’eau iodée
|
|
|
|
|
|
|
Réaction à la liqueur de Fehling
|
|
|
|
|
|
|
Glucide (s) mis en évidence
|
|
|
|
|
|
- Porter à ébullition
environ 100 mL d’eau du robinet dans un bécher de 250 mL.
- Plonger les tubes à
essais dans le bécher et aux dates indiquées refroidir un tube.
- Partager son contenu pour
procéder aux deux tests des glucides. Ajouter 5 gouttes de soude avant le
test à la liqueur de Fehling.
Compléter le tableau et préciser le rôle du tube 1.
Quel est le temps nécessaire pour que l’amidon soit totalement
hydrolysé en présence d’acide chlorhydrique à 100 °C ?
Que s’est-il passé au cours de cette réaction d’hydrolyse ?
Les agents antioxygènes
|
Notions et contenus
|
Activités envisageables
|
Connaissances et savoir-faire exigibles
|
|
Effets du dioxygène de l'air et de la lumière sur certains
aliments. Rôle de la lumière dans l'oxydations des produits naturels : les
radicaux libres.
Limites
l'écriture des réactions radicalaires et des réactions d'oxydation
n'est pas au programme.
L'écriture des réactions chimiques mises en jeu dans les dosages n'est
pas une compétence exigible.
|
- Tests gustatifs comparés sur des eaux de consommation.
Approche du T°H par action comparative d'une solution savonneuse (dans
l'alcool).
- Mesure du pH.
Dosage des ions chlorure ou des ions hydrogénocarbonate.
|
- Recherche documentaire (lecture des notices de
composition alimentaire) ou expérimentale qualitative sur l'oxydation des
aliments.
Exemples : étude sur le rancissement des graisses, étude sur l'oxydation
d'un vin.
- Recherche d'antioxygènes dans les aliments par lecture des notices de
composition alimentaire.
- Dosage d'un antioxygène.
|
Antioxydants (extrait
d’une recherche)
Que sont les antioxydants ?
Les antioxydants sont des molécules qui aident à protéger les aliments
contre les réactions d'oxydation qui accélèrent le vieillissement. Il peut
s'agir d'altérations dues à l'oxygène de l'air, à la lumière, aux traces de
métaux ou à certaines enzymes.
Où trouve-t-on les antioxydants ?
Principalement dans les fruits et légumes, mais on en trouve également dans
le thé et le vin.
Ils se classent en 3 catégories : les vitamines (E, C et ß-carotène),
les oligo-éléments (Sélénium, Cuivre, Manganèse et Zinc), et de nombreux
autres micro-nutriments d'origine végétale comme, par exemple, les polyphénols.
Liste des additifs par ordre croissant des n° CE (E 300)
Acide L-ascorbique, Vitamine C (E 300)
L-ascorbate de sodium, Vitamine C (E 301)
L-ascorbate de calcium, Vitamine C …
Etude d'un antioxydant :
l'acide ascorbique
Mode d’action d’un antioxydant :
De très nombreux oxydants peuvent oxyder l’acide ascorbique : c’est en
particulier le cas du dioxygène. C’est la raison pour laquelle l’acide
ascorbique est appelé antioxygène : réagissant avec le dioxygène de l’air,
il empêche celui-ci d’oxyder les aliments et protège ainsi les corps gras
contre le rancissement, limite l’oxydation des ions nitrites en ions nitrates. ..
l’acide ascorbique :
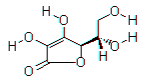
Donner la formule brute de l’acide ascorbique.
Principe du dosage :
On va retrouver par dosage la masse d’acide ascorbique contenu dans un
sachet de vitamine C 1000.
L’acide ascorbique (noté AA) réagit avec l’eau iodée selon la réaction
suivante :
|
C6H8O6 +
I2 ------> C6H6O6
+ 2I- + 2H+
|
dans laquelle
l’amidon nous sert d’indicateur de fin de réaction.
Pourquoi a-t-on choisi l’amidon ?
·
Réaliser ce dosage et noter le volume V1 d’eau
iodée versé à l’équivalence.
La concentration de l’eau iodée est 5.10-3 mol.L-1.
Calculer la quantité d’eau iodée qui a réagi.
Une mole de I2 réagit avec 1mole de C6H8O6
(soit 176 g).
En déduire la quantité d’acide ascorbique dosé.
La masse molaire moléculaire est de 176 g.mol-1 pour
l’AA. Quelle est la masse d’AA contenue dans cet échantillon de dosage ?
Sachant que 10 mL d’AA ont été dosés, quelle est la masse d’AA dans le
litre de solution ?
Pourquoi le sachet porte-t-il l’indication vitamine C1000 ?
Dosage de l’acide ascorbique contenu dans un jus de fruit :
Recommencer le même dosage avec un jus de fruit et noter le volume V2
d’eau iodée versé à l’équivalence.
En admettant que la masse d’AA contenue dans l’échantillon est
proportionnelle au volume d’eau iodée versé, quelle est la masse d’AA dans
les10mL de jus de fruits ?
Le résultat est-il en accord avec les données figurant sur l’étiquette du
fabricant de cette boisson ?
L’emploi d’AA est limité à 300 mg / kg d’aliment. Ce jus de fruits est-il
conforme à la législation en vigueur ?