L'atome
source :http://www.cea.fr/jeunes/themes/la_radioactivite/l_atome/la_physique_nucleaire
AU CŒUR DE
LA MATIERE : LES
ATOMES :
Les philosophes, tels que Leucippe et Démocrite qui ont
tenté de répondre aux questions portant sur le commencement et la fin du
cosmos, l’unité et la diversité des êtres matériels, ont trouvé un dénominateur
commun pour tous les êtres, pour tout l’univers : l’atome.
Au fil des années et des siècles, cette volonté de comprendre l’origine du
monde a contribué à considérer l’atome comme un objet physique par les
physiciens. Cette “petite unité de matière” a permis de faire un grand pas dans
la compréhension de notre univers et est encore au centre de nombreuses
recherches, mais elle n’a pas dit son dernier mot.
Un atome est constitué d'un noyau de protons et de neutrons, et d'un nuage d'électrons.
Historique
-Dès le Ve siècle avant Jésus-Christ, Leucippe, puis Démocrite, nomment “atome” (du grec “atomos” qui ne peut être coupé) cette “petite unité de matière”, éternelle, illimitée et constamment en mouvement rapide.
Il faudra attendre plus de 2 500 ans pour approfondir cette connaissance. En 1897, Joseph John Thomson découvre l’un des composants de l’atome, l’électron. En 1904, il imagine que les atomes sont des sphères remplies d’une substance électriquement positive et fourrée d’électrons négatifs.
-En 1911, un savant anglais, Ernest Rutherford, voit que des particules projetées sur de la matière la traversent comme si c’était du vide, sauf quelques-unes, très rares qui sont déviées ou même rebondissent comme des balles de fusil tirées contre une large et haute haie recelant quelques billes d’acier. Il découvre ainsi le noyau atomique qui concentre presque toute la masse de l’atome dans un volume cent mille fois plus petit que ce dernier.
-On trouve ensuite que la charge électrique positive du noyau est portée par plusieurs corpuscules, les protons. Et, en 1932, James Chadwick découvre le neutron, constituant neutre du noyau. Lorsqu’il est seul, il se désintègre en proton et en électron, lorsqu’il est à l’intérieur du noyau atomique, il est stable.
-En 1969, des physiciens bombardent des noyaux avec un faisceau de particules (des électrons) suffisamment accélérées pour pénétrer au cœur des nucléons. Et l’histoire de Rutherford se répète au sein même du nucléon, certains électrons rebondissent de façon apparemment bizarre. Ce ne peut être que sur des corpuscules encore plus petits. Ainsi sont découverts les quarks. Chaque nucléon en contient trois.
-La dernière découverte est celle du quark. Peut-être un jour découvrira-t-on des particules encore plus petites à l’intérieur des quarks ! Mais il faudra disposer d’accélérateurs de particules encore plus puissants. Plus on veut voir petit, plus le “microscope” doit être gros.
Les planètes, l’air, l’eau, les pierres, les êtres vivants… tous les corps de la nature sont
constitués à partir d’atomes ou d’assemblages d’atomes (molécules…).
Contrairement à son étymologie, l’atome n’est pas indivisible. Comment est-il
constitué ?
Un atome est composé :
-d’un noyau central qui est un assemblage de protons et de neutrons. Les protons et les neutrons constituent les nucléons (du mot grec “nucleus” signifiant noyau) ;
-d’un nuage périphérique composé d’un cortège d’électrons, qui tournent à des vitesses prodigieuses autour du noyau. Il est impossible de vraiment se représenter leurs trajectoires : seules des formules mathématiques permettent de prédire dans le nuage qu’ils forment autour du noyau, les zones où l’on a le plus de chances de les rencontrer.
Il existe beaucoup d’atomes différents mais ils sont tous fabriqués à partir de protons, de neutrons et d’électrons tous identiques.
LES TAILLES D'UN
ATOME ET DE SON NOYAU
Le diamètre du nuage électronique sphérique de l’atome est de
l’ordre de 10-
Le noyau est encore beaucoup plus petit. Il occupe une sphère
d’un diamètre de 10-
« L’espace
entre le noyau et le nuage d’électrons est vide. »
Dans l’atome, la masse n’est pas répartie de façon homogène. Les protons et
les neutrons ont à peu près la même masse, mais ils sont environ 2 000
fois plus lourds qu’un électron, si bien que le noyau concentre
quasiment toute la masse de l’atome et que la matière dont est fait un
noyau est un million de milliards de fois plus dense que la matière ordinaire.
Si tous les noyaux de
« Dans la nature, tous les corps sont constitués à partir
d'atomes ou d'assemblages d'atomes (molécules)… »
Des trois éléments constituant l’atome, seul le neutron ne porte pas de charge électrique, il est neutre, d’où son nom. Un proton porte une charge positive et un électron, une charge négative. Un atome dans son état normal comprend autant de protons que d’électrons. Il est donc électriquement neutre. Cependant, dans certaines conditions (réactions chimiques…), l’atome peut perdre ou gagner un ou plusieurs électrons et peut alors être chargé positivement ou négativement. Il est alors appelé ion.
Selon le nombre de leurs constituants,
les atomes relèvent de catégories différentes.
« Les isotopes sont en quelque sorte des atomes “frères” qui possèdent les mêmes propriétés chimiques mais un nombre différent de neutrons. »
LE NOM DES ATOMES
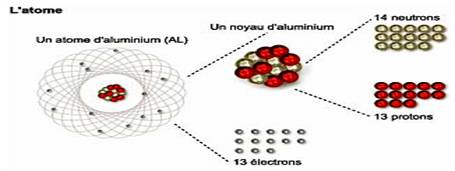
Un atome se caractérise par son nombre de protons (identique à celui des électrons)
et par son nombre de neutrons.
Il est appelé par le nom de son élément chimique suivi de son nombre total de
nucléons (nombre de masse). Par exemple, oxygène 16, fer 59.
Le nom de l’élément chimique permet de connaître le nombre de ses protons. Et
du nombre de ses nucléons, par soustraction du nombre de ses protons, on peut
déduire le nombre de ses neutrons.
LES ÉLÉMENTS
CHIMIQUES
Un élément chimique est un ensemble d’atomes comportant le même
nombre de protons. Il est désigné par un symbole d’une ou deux lettres
(par exemple, 1H pour l’hydrogène qui n’a qu’un proton, 26Fe
pour le fer qui a 26 protons).
Les atomes présents naturellement sur Terre appartiennent à 90 éléments
chimiques comprenant de 1 à 92 protons. Les éléments chimiques, technétium (Tc)
avec 43 protons et prométhéum (Pm) avec 61 protons, n’existent pas à l’état
naturel. Ils peuvent cependant être créés artificiellement ainsi que d’autres
éléments chimiques comprenant plus de 92 protons comme, par exemple, le
plutonium (Pu) avec 94 protons.
LES ISOTOPES
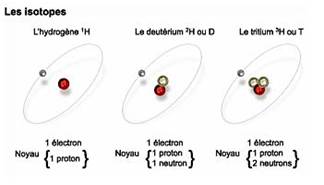
Les noyaux ne sont pas uniquement constitués de protons, ils contiennent aussi des neutrons. Des atomes d’un élément chimique comportant un nombre différent de neutrons sont des isotopes de cet élément.
Par exemple :
- Tous les isotopes de l’hydrogène ont un proton et zéro, un ou deux neutrons. Ce sont l’hydrogène léger (appelé souvent hydrogène tout court car c’est le plus répandu), l’hydrogène lourd ou deutérium, et le tritium (voir schéma "les isotopes").
- Tous les isotopes du
carbone ont 6 protons. Les plus abondants ont 6, 7 ou 8 neutrons. Un atome
est appelé par le nom de son élément chimique suivi du nombre total de ses
nucléons : carbone 12, carbone 13 et carbone 14.
Les propriétés chimiques d’un atome dépendant seulement du nombre et de la disposition des électrons dans son nuage, tous les isotopes d’un même élément ont les mêmes propriétés chimiques. Cependant, la légère différence de masse de leur noyau fait que leurs propriétés physiques se différencient quelque peu.
 Les
quatre interactions fondamentales
Les
quatre interactions fondamentales
« Une boussole est perturbée par les éclairs d’un
orage : c’est l’une des manifestations de la force magnétique qui provient
du mouvement des charges électriques. »

La force électrique régit les phénomènes comme la foudre et intervient dans l’interaction électromagnétique.
« La gravitation
varie avec la distance. Quand on tombe de haut, on se fait mal ! »
La gravitation, plutôt faible comparée à d’autres forces, est pourtant celle que nous ressentons le plus.
Dans la nature, tous les objets ont une action l'un sur l'autre. On dit qu'ils interagissent.
Dans la nature, les objets sont soumis à toutes sortes de forces qui s’exercent à distance. Ainsi, par exemple, deux masses s’attirent, deux charges électriques s’attirent ou se repoussent suivant leur signe. Les objets ont une action l’un sur l’autre. Ils interagissent. Suivant la nature des objets, les forces d’interaction (ou plus simplement interactions) sont de quatre types fondamentaux : l’interaction forte, l’interaction électromagnétique, l’interaction faible et la gravitation.
L'INTERACTION
FORTE
L’interaction forte, ou force nucléaire forte, assure la cohésion du noyau en faisant fortement s’attirer les nucléons. Elle ne s’exerce qu’à des distances très courtes, quelques diamètres de noyaux. À distance égale, elle est 100 à 1 000 fois plus intense que l’interaction électromagnétique.
L'INTERACTION
ÉLECTROMAGNÉTIQUE
L’interaction électromagnétique se manifeste sous deux formes, la force électrique et la force magnétique. La première régit les phénomènes électriques comme la foudre, les cheveux qui se dressent sur la tête quand il y a de l’électricité dans l’air, et la deuxième, les phénomènes magnétiques comme la boussole, les électroaimants, etc. La force magnétique est un effet provenant du mouvement des charges électriques, ainsi une boussole est perturbée par les éclairs d’un orage. Cette interaction fait se repousser deux charges électriques de même signe (deux protons, par exemple), et s’attirer deux charges de signes opposés (un électron et un noyau). Elle porte à l’infini, mais elle est quatre fois plus faible à distance double (loi de “l’inverse carré de la distance”). Elle sous-tend les propriétés chimiques des atomes.
L'INTERACTION
FAIBLE
L’interaction faible, ou force nucléaire faible, est responsable de certains phénomènes de la radioactivité (par exemple, la radioactivité bêta). Sa portée est extrêmement faible, de l’ordre de quelques centièmes de la taille d’un nucléon, mais elle régit les réactions thermonucléaires qui permettent au Soleil et aux étoiles de produire de l’énergie. Elle est environ 100 000 fois plus faible que l’interaction forte.
La gravitation, responsable de l’attraction des masses, explique la
pesanteur et le mouvement des corps célestes. Elle varie avec la
distance suivant la même loi que la force électromagnétique. C’est de très loin
la force la plus faible des quatre : 10-40 fois plus faible que
la force électromagnétique ! Pourtant c’est celle que nous ressentons le
plus : quand on tombe de haut, on se fait mal ! Car la masse qui nous
attire est gigantesque, c’est celle de
 La
physique nucléaire
La
physique nucléaire
« Au cœur de l’atome, protons et neutrons “dansent” à plus
de 30 000 km/s.
Pourtant, grâce à la force nucléaire, ils ne s’éparpillent pas. »
UNE BRÈVE
DESCRIPTION DU NOYAU
Un atome est donc une sorte de système solaire en miniature : des
mini-planètes, les électrons, tournent autour d’un mini-soleil, le noyau. La
physique nucléaire, c’est l’étude du noyau atomique et de la force énorme –
l’interaction forte – qui lie ses constituants, les nucléons (protons et
neutrons).
Le noyau est un objet extrêmement dense, complexe et petit. Il est comme une
poupée russe qui contient des poupées de plus en plus petites, des poupées
gigognes : le noyau contient des nucléons, qui renferment chacun
trois quarks. Il y a deux sortes de nucléons : les protons,
chargés positivement et les neutrons qui sont neutres.
Dans ce minuscule volume, non seulement les protons se repoussent très
fortement car ils sont porteurs de charges électriques de même signe, mais
protons et neutrons dansent un vertigineux ballet à plus de
30 000 km/s (plus d’un dixième de la vitesse de la lumière, soit le
tour de