La
physique quantique
Le texte qui suit donne un aperçu historique très sommaire des
découvertes qui ont imposé la mécanique quantique. Les physiciens plutôt
perplexes au début se sont finalement
ralliés aux « idées nouvelles » de Bohr, Planck, De Broglie,
Heisenberg…
Einstein était resté un peu réticent devant cette façon de
penser : « Dieu ne joue pas aux dés »disait-il. La notion
de probabilité de présence d’une particule comme solution d’une équation ne le
satisfaisait sans doute pas. C’est néanmoins le verdict de l’expérience
qui fit le succés de cette
mécanique.
I-La théorie des quanta
La physique quantique est née avec le XXième siècle, en 1900, à la suite des
travaux de Max Planck.
Max Planck étudiait le phénomène de "rayonnement des corps noirs".
Selon la théorie classique, les échanges d'énergie à l'intérieur du corps noir
s'effectuaient de manière continue. Cette théorie prédisait que l'intensité du
rayonnement d'un corps noir pour une longueur d'onde donnée était
proportionnelle à la quatrième puissance de la valeur de cette longueur d'onde.
Ce résultat n'était pas en accord avec
les observations expérimentales d'une part, et impliquait que l'énergie totale
rayonnée par un corps noir était infinie d'autre part. Il fallait donc réviser
en profondeur la théorie.
Max Planck prit le problème à l'envers et tenta de trouver une formulation
analytique de la courbe expérimentale observée. Cette formulation obtenue, il lui
fallut l'interpréter physiquement. La seule interprétation acceptable qu'il
trouva consistait à remplacer les échanges continus d'énergie par des quantités
finies qu'il baptisa quanta. La quantité d'énergie transportée par un
quantum d'énergie est alors proportionnelle à la fréquence du rayonnement
associé. Le rapport de proportionnalité est égal à une constante nommée constante
de Planck et représentée par la lettre h.
Ainsi, selon la théorie des quanta de Planck, tout
échange d'énergie entre quelques corps que ce soit, s'opère par des transferts
de quantités d'énergie finies. On dit que les échanges d'énergie sont quantifiés.
Pour un objet macroscopique tel
qu’un véhicule automobile, l’aspect quantique des échanges d’énergie est
totalement indécelable et il est tout à fait logique de ne pas en tenir compte.
Par contre, à l’échelle atomique, il devient prépondérant .Le comportement d’entités
microscopiques tels que le noyau, l’atome, les molécules, ne peut être expliqué
autrement qu’en utilisant la théorie des quanta d’énergie de Planck.
II-Une
preuve de la quantification de l’énergie de l’atome.
L’expérience
de Franck et de Hertz (1914)
Cette
expérience a l’avantage d’être simple à mener et à interpréter.
La théorie :
D'après la mécanique
quantique, les électrons des atomes ne peuvent occuper que des niveaux d’énergie discrets. L’absorption
ou l’émission d'énergie se fait alors de
manière discrète par des quanta d'énergie.
Cette quantité d'énergie correspond à la transition
électronique (c’est la théorie de Bohr), mais aussi à l'énergie transmise à
une particule s'il s'agit d'une diffusion
inélastique. Afin de mettre en évidence la quantification des niveaux
d'énergie, Franck et Hertz ont cherché à montrer l'absorption de certains
électrons. Pour être absorbés ces derniers doivent posséder une certaine énergie bien précise correspondant à une transition électronique, autrement dit,
à la différence d'énergie ΔE
entre les niveaux d'énergie final et initial
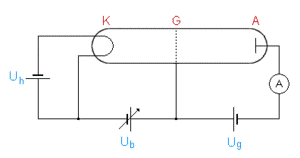
Principe du montage ::
à gauche la cathode
K,à droite l'anode
A.
Les électrons circulent de K vers A.
Dans l'expérience, Franck et Hertz ont fait circuler un faisceau
d'électrons dans un tube à vide contenant du mercure gazeux. Pour y arriver,
ils ont utilisé une triode c'est-à-dire
un dispositif composé d'une cathode, d'une grille polarisée et d'une anode.
Les électrons, émis de la cathode, peuvent alors entrer en
collision avec des atomes de mercure.
Détails de l'expérience :
L'ensemble de la triode est contenu à l'intérieur d'une capsule en
verre qui contient le mercure. L'expérience peut être réalisée pour différentes
températures, mais le mercure doit être sous forme gazeuse afin de permettre la
circulation des électrons. Le mercure devient gazeux à partir de 630 K sous
pression atmosphérique, mais il est possible d'éviter d'avoir à obtenir une
telle température, en travaillant à
pression réduite et en chauffant entre 100 et 200 °C.
Pour que les électrons soient arrachés et qu'ils aient une vitesse
suffisamment importante, une tension d'accélération réglable est établie entre
la cathode et la grille.
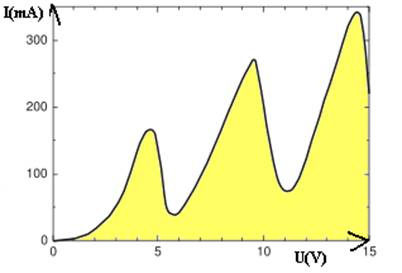
La courbe représentant le courant de l'anode en fonction de la tension accélératrice,
montre qu'il y a des pics de courant.
L'énergie (et alors la vitesse) des électrons est représentée par la potentiel
électrique que subissent les électrons. Cette courbe est de type
pseudo-périodique de période 4,9 V et dont l'amplitude augmente en fonction de
la tension d'extraction.
Durant leur course entre la cathode et l'anode. Il y a deux types
de chocs :
 des chocs élastiques où il n'y a pas
de transfert d'énergie des électrons du faisceau avec les atomes de mercure
percutés, et les électrons gardent donc
leur énergie,
des chocs élastiques où il n'y a pas
de transfert d'énergie des électrons du faisceau avec les atomes de mercure
percutés, et les électrons gardent donc
leur énergie,
 des chocs inélastiques,
et dans ce cas, les électrons émis par la cathode vont percuter les électrons
de plus basse énergie des atomes de mercure, et ceux-ci vont passer sur une
orbite d'énergie supérieure, suivant l'interprétation de Bohr.
des chocs inélastiques,
et dans ce cas, les électrons émis par la cathode vont percuter les électrons
de plus basse énergie des atomes de mercure, et ceux-ci vont passer sur une
orbite d'énergie supérieure, suivant l'interprétation de Bohr.
La variation de courant reçu par l'anode est mesurée en fonction
de l'énergie cinétique des électrons, et il est ainsi possible d'en déduire les
pertes d'énergie des électrons lors des collisions.
L'explication de Franck et Hertz repose sur le concept de chocs
élastiques et inélastiques. En effet,
selon la quantification des niveaux d'énergies, les chocs inélastiques ne sont
possibles seulement lorsque les électrons accélérés ont l'énergie suffisante
pour permettre une transition électronique. Dans le cas de chocs
élastiques, l'énergie des électrons reste inchangée. La tension d'extraction
est en fait la mesure directe de l'énergie des électrons : plus elle est
forte, plus les électrons vont vite. L'intensité de l'anode mesure quant à elle
le nombre d'électron arrivant.
La courbe est en fait
l'illustration que, pour un potentiel donné, les électrons cèdent une énergie
de 4,9 eV à un atome de mercure, ce qui s'observe alors par un creux sur la
courbe. Ainsi, un
électron ayant 5,1 eV d'énergie cinétique n'aura plus que 0,2 eV d'énergie
cinétique après un choc inélastique avec un autre électron d'un atome de
mercure. Cet autre électron voit alors son énergie augmenter et se retrouve,
selon l'interprétation de Bohr, sur une orbite de plus haute énergie. Pour un
électron de 15,6 eV, on pourra avoir 3 chocs inélastiques. Il lui restera
alors, après ces 3 chocs, une énergie de 15,6 – 3 x 4,9 = 0,9 eV.
C'est cette probabilité de faire un certain nombre de chocs dans
l'enceinte qui fait que la hauteur des creux augmente, malgré les oscillations.
III-La mécanique ondulatoire,
l'équation de Schrödinger et le principe de complémentarité
Dès 1905, Albert Einstein interpréta avec succès l'effet photo-électrique à
l'aide de la toute jeune théorie des quanta de Planck (ce qui lui valut le prix
Nobel de physique). L'idée force de cette interprétation réside dans le fait
que le quantum d'énergie associé à une fréquence de lumière se comporte comme
une particule de matière. Einstein baptisa ce corpuscule de lumière le photon.
Ce qui est véritablement révolutionnaire dans l'idée d'Einstein tient dans
le fait que la lumière avait acquis, avec la théorie de l'électromagnétisme
achevée par Maxwell, une nature résolument ondulatoire. La lumière était alors
perçue comme une onde électromagnétique. Avec l'hypothèse du photon, la lumière
apparut tout à coup comme une entité hybride, se comportant tantôt comme une
onde, tantôt comme une particule. L'invention par Einstein du concept de photon
fut le premier pas vers une révolution en profondeur des fondements mêmes de la
physique classique.
Alors que le photon conférait à la lumière - l'onde lumineuse - un caractère
corpusculaire, Louis de Broglie appliqua l'idée inverse aux particules
matérielles. Il émit l'hypothèse que le comportement des particules (les
particules connues à l'époque étaient l'électron, le proton et le neutron)
pouvait à son tour être décrit à la fois comme la manifestation d'un corpuscule
et la manifestation d'une onde. Il associa donc une onde à chaque particule
matérielle et développa une mécanique pour manipuler ces nouveaux êtres : la
mécanique ondulatoire.
Selon la mécanique ondulatoire, à toute particule est associée une onde dont
la longueur d'onde est inversement proportionnelle à l'énergie de la particule.
Il s'ensuit que plus une particule est énergétique (plus sa vitesse est
grande), plus la longueur d'onde qui lui est associée est courte.
L'équation des ondes associées à ces particules fut finalement énoncée par
Erwin Schrödinger en 1926 comme suit :
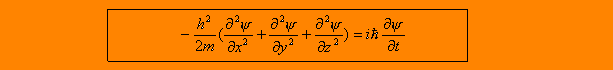
Les ondes associées aux électrons furent mises en évidence par Clinton
Davisson en 1925 par une expérience d'interférence (dite expérience des
trous d'Young en référence au physicien britannique Thomas Young qui en 1801
mis en évidence des interférences lumineuses en faisant passer un faisceau
lumineux entre deux fentes). Les électrons sont émis par une source, sont
accélérés puis sont envoyés sur un cristal dont l'alignement atomique joue le
rôle des fentes dans l'expérience de Young. Selon une interprétation purement
corpusculaire de la nature des électrons, la répartition des électrons après le
passage de la plaque devrait être celle-ci :
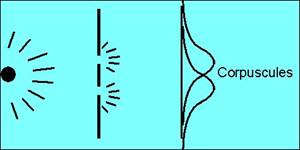
Or, l'expérience a montré que les électrons se répartissaient en franges
similaires à des franges d'interférence. L'observation de franges d'interférence
implique nécessairement que les objets observés sont des ondes et non des
corpuscules !
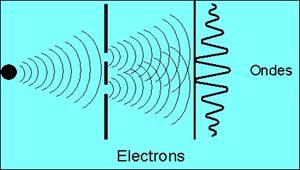
Pour résumer, les électrons se comportent comme des corpuscules dans le
phénomène photo-électrique et comme des ondes dans l'expérience des trous
d'Young.
Ainsi les physiciens durent conclure que, d'une part les ondes
électromagnétiques possédaient également une nature corpusculaire, et que
d'autre part les particules de matière possédaient aussi une nature
ondulatoire. Il y avait là un paradoxe insurmontable. Niels Bohr trancha le
débat en énonçant le principe de complémentarité qui fit la synthèse de
ces résultats apparemment inconciliables.
Principe de complémentarité : les particules et la lumière sont des quanta
d'énergie dont le comportement est à la fois corpusculaire et ondulatoire
(dualité onde-corpuscule).
IV-"Effondrement" de l'onde et
relations d'incertitude d'Heisenberg
Qu'est-ce qui détermine le comportement ondulatoire ou corpusculaire d'une
particule ? Ou en d'autres termes, qu'est-ce qui explique que dans certains
phénomènes, les particules se comportent comme des ondes et dans d'autres comme
des corpuscules ?
Avant tout, il faut dire que les particules sont toujours décrites comme des
entités duales onde-corpuscule. En fait, selon les phénomènes, la nature
ondulatoire l'emporte sur la nature corpusculaire ou inversement, mais ces deux
natures sont toujours présentes simultanément.
Comme nous l'avons dit précédemment, la longueur d'onde de l'onde associée à
une particule est inversement proportionnelle à l'énergie de la particule.
Lorsque cette longueur d'onde est inférieure ou est de l'ordre des
dimensions des "objets" qui interviennent dans le phénomène, alors la
nature corpusculaire de la particule est prépondérante. Inversement, si cette
longueur d'onde est supérieure aux dimensions des "objets" impliqués,
la nature ondulatoire de la particule va être observée. Or, la longueur d'onde
est courte pour des particules très énergétiques. On en conclut que les
phénomènes se produisant à hautes énergies mettront plutôt en évidence un
comportement corpusculaire des particules alors que, inversement, les
phénomènes à basses énergies seront plutôt de nature ondulatoire.
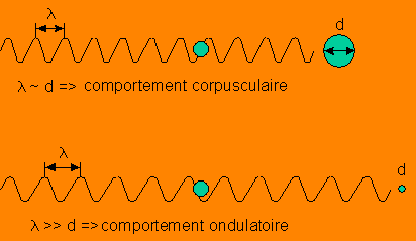
De façon imagée, on peut dire qu'une particule ayant une onde avec une
grande longueur d'onde n'est pas bien localisée et donc son comportement est
plutôt celui d'une onde (une onde est un phénomène non localisé). Lorsque la
longueur d'onde se raccourcit, la particule apparaît de plus en plus localisée
et se comporte de plus en plus comme un corpuscule (un corpuscule est une
entité ayant une dimension et une position bien déterminées). En fait, Werner
Heisenberg a étudié de près cette question et en a déduit des relations liant
la précision que l'on peut obtenir de la vitesse et de la position d'une
particule d'une part, et la précision de la mesure de son énergie en fonction
de la durée de la mesure d'autre part. Ces relations sont connues sous le nom
de relations d'incertitude d'Heisenberg.

Ce que disent ces relations c'est que :
- Si l'on connaît
parfaitement la position d'une particule, on ne peut en connaître la
vitesse et inversement,
- Sur de très courtes durées
l'incertitude sur la mesure de l'énergie est très grande, c'est-à-dire que
l'énergie peut fluctuer considérablement sur de très courtes durées !
Les bases mêmes de la mécanique sont sérieusement ébranlées par ces
relations d'incertitude !!!
V-Interprétation de la fonction d'onde
L'équation de l'onde associée aux photons est l'équation des ondes
électromagnétiques alors que celle de l'onde associée aux particules
matérielles est l'équation de Schrödinger. C'est là que réside la principale
différence entre les particules de matière et les photons. C'est une différence
de taille car l'onde des photons est bien réelle (les ondes électromagnétiques
sont bien réelles) alors que l'onde associée aux particules de matière est
purement abstraite (les solutions de l'équation de Schrödinger ne sont pas des
fonctions réelles mais complexes). Dans ce cas, comment interpréter cette onde
associée aux particules de matière ?
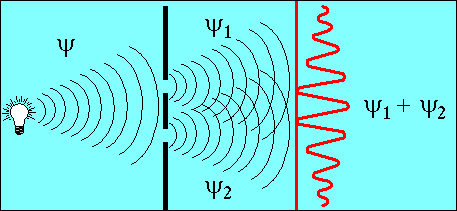
Pour interpréter la fonction d'onde, revenons aux photons. Dans une
expérience d'interférence comme celle qui est représentée ci-dessous, on
obtient sur l'écran un ensemble de franges qui déterminent l'intensité
lumineuse en chaque point de l'écran. Si l'on se souvient de ses cours de
physique, l'on sait que l'intensité lumineuse en un point n'est pas la somme de
l'amplitude des ondes qui passent par chacun des deux trous mais le carré
de la somme des amplitudes de ces ondes.
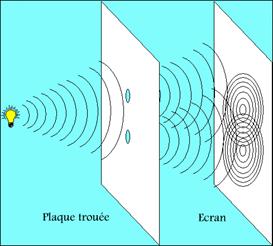
Raisonnons maintenant en termes de photons, c'est-à-dire de quanta. Les
franges sombres de la figure d'interférence sont sombres parce qu'aucun photon
n'est parvenu à cet endroit. Ceci peut paraître une "la palissade"
cependant si l'on considère les photons émis par la source lumineuse comme une
population de particules (ou de quanta) que l'on ne peut distinguer les unes
des autres, l'étude de la répartition de ces dernières sur l'écran peut être
traitée d'un point de vue statistique. Il est alors possible d'affirmer
que les franges sombres sont des endroits où les photons ont une probabilité
nulle d'arriver, ou de se trouver. A l'inverse, à l'endroit des
franges brillantes, la probabilité de trouver un photon est maximale.
Par ce raisonnement très simple, nous avons associé la luminosité observée à
un endroit de l'écran à la probabilité de trouver un photon à cet endroit. Or
la luminosité n'est rien d'autre que l'intensité de l'onde lumineuse,
c'est-à-dire le carré de l'amplitude de l'onde. Ainsi, la probabilité de
trouver un photon à un endroit donné est-elle proportionnelle au carré de
l'amplitude de l'onde électromagnétique à cet endroit !
Ce résultat peut être transposé aux particules de matière telles que les
électrons, les protons, etc. On obtient ainsi une interprétation de la fonction
d'onde associée à un quantum : la probabilité de trouver un quantum (ou une
particule) à un endroit de l'espace est proportionnelle au carré de l'amplitude
de la fonction d'onde à cet endroit.
Comme on le voit, en physique quantique, il n'est possible de calculer que
des probabilités de réalisation de prédictions. La description quantique des
phénomènes n'est donc plus déterministe (c'est-à-dire permettant de
prévoir avec exactitude les valeurs des grandeurs physiques mises en jeu) mais indéterministe.
En cela la physique quantique se distingue radicalement de la physique
classique qui est fondamentalement déterministe.
Les physiciens mirent au point un formalisme et un cadre généraux permettant
de décrire et de calculer les prédictions des phénomènes quantiques. Ce
formalisme a été baptisé la mécanique quantique