Source : Lydie Germain lycée Clémenceau Reims : (http://fizik.chimie.lycee.free.fr/)
|
Objectifs :
|
Connaître la signification
du symbole 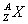 et donner la
composition du noyau correspondant. et donner la
composition du noyau correspondant.
Définir l’isotopie et
reconnaître des isotopes.
Reconnaître les domaines de
stabilité et d’instabilité sur un diagramme N, Z).
Définir un noyau
radioactif.
Connaître et utiliser les
lois de conservation.
Définir la radioactivité a, b–,
b+,
l’émission g
et écrire l’équation d’une réaction nucléaire pour une émission a, b–
ou b+
en appliquant les lois de conservation.
À partir de l’équation
d’une réaction nucléaire, reconnaître le type de radioactivité.
|
1.
Émissions radioactives
Historique :
H. Becquerel découvre la radioactivité en 1896, P. et M.
Curie étudient le phénomène et découvrent un nouvel élément : le radium …
Au fur et à mesure des découvertes sur la matière à l’échelle
microscopique, on a découvert un certain nombre de particules avant même de
connaître le noyau atomique et ses constituants. Les propriétés de ces
particules ont même permis la découverte du noyau par Rutherford en 1911.
Plus tard, les particules émises par les corps radioactifs
ont été identifiée comme étant des noyaux d’hélium ou des électrons.
Une source radioactive est constituée d’atomes pouvant
éjecter des particules (autrefois appelées « rayons »).
Consulter éventuellement:Radioactivité:historique,rayonnements,applications(diaporama)
2.
Les noyaux atomiques et leur stabilité
2.1.
Composition d’un noyau atomique
Le noyau est constitué de particules appelées nucléons.
Les nucléons sont de deux sortes : les protons et les neutrons.
Le proton porte une charge électrique positive 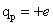 (charge élémentaire de
valeur
(charge élémentaire de
valeur 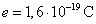 ).
).
Le neutron ne porte pas de charge électrique, il est neutre 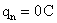 .
.
Un proton et un neutron ont approximativement la même
masse : 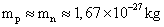 .
.
Par définition :
Le nombre de nucléons d’un
noyau est désigné par A.
Le nombre de protons d’un noyau s’appelle nombre de charges ou numéro atomique
et se note Z.
Le nombre de neutrons est
noté N et 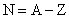
Le noyau de l’atome de symbole X est représenté par : 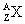
avec : A le
nombre nucléons et Z le nombre de charges (numéro atomique).
2.2.
Les nucléides
Rappel : un élément chimique est l’ensemble des
particules ayant même numéro atomique Z.
Un nucléide est l’ensemble des noyaux ayant le même nombre de
proton et le même nombre de neutrons.
Un nucléide est donc un ensemble de noyaux identiques ayant
même A et même Z.
Un nucléide est caractérisé par A et Z.
On connaît environ 1500 à 2000 nucléides dont environ 350
naturels.
2.3.
Les isotopes
Des noyaux faisant partie du même élément chimique, mais pas
du même nucléide, sont dits isotopes.
Des isotopes ont donc le même numéro atomique Z mais pas le
même nombre de nucléons A.
Exemples :
Ø Les trois isotopes de l’hydrogène :
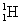 (proton) ;
(proton) ; 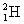 (deuton ou deutéron : noyau de deutérium) ;
(deuton ou deutéron : noyau de deutérium) ; 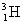 (triton : ou
noyau de tritium)
(triton : ou
noyau de tritium)
Ø Quelques isotopes du carbone :
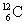 (noyau de carbone
12) ;
(noyau de carbone
12) ; 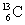 (noyau de carbone 13) ;
(noyau de carbone 13) ; 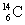 (noyau de carbone 14).
(noyau de carbone 14).
2.4.
Stabilité d’un noyau atomique
Les protons se repoussent et malgré cela les noyaux
comportant plusieurs protons dans une zone de très petites dimensions existent.
C’est l’interaction forte qui unit les différents nucléons,
cette interaction est beaucoup plus intense (environ ´ 1000) que la répulsion
due à l’interaction électromagnétique entre charges de même signe. Mais la
portée de l’interaction forte est de l’ordre de 1,5 fm, alors que l’interaction
électromagnétique porte à l’infini, ainsi lorsque le volume du noyau devient
trop important la somme des forces répulsives peut rivaliser avec la somme des
forces attractives.
Si la cohésion du noyau est insuffisante, il est instable et
peut se désintégrer spontanément : le noyau est radioactif.
Dans certains cas, une autre interaction dite
« faible » rend également le noyau instable.
Les nucléides radioactifs sont aussi appelés radionucléides.
Il n’existe que 274 nucléides stables.
Si on classe les nucléides stables dans un diagramme 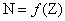 , on constate que pour A < 20 les nucléides stables
vérifient la relation approchée A = 2 Z (ou N = Z), puis pour A > 20, les
noyaux présentent un excès de neutrons et le rapport A/Z augmente et tend vers
2,5 pour les noyaux les plus lourds.
, on constate que pour A < 20 les nucléides stables
vérifient la relation approchée A = 2 Z (ou N = Z), puis pour A > 20, les
noyaux présentent un excès de neutrons et le rapport A/Z augmente et tend vers
2,5 pour les noyaux les plus lourds.
Cette zone regroupant les noyaux stables est appelée
« la vallée de stabilité ».
Les noyaux situés au dessus présentent un excès de neutrons,
ceux en dessous un défaut de neutrons, et ceux au-delà de Z = 82 ont trop de
nucléons, ce sont les « noyaux lourds ».
Voir graphique du livre page 81.
3.
Les réactions nucléaires spontanées
3.1.
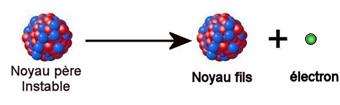
La radioactivité
La radioactivité est la transformation spontanée d’un noyau
au cours du temps. Cette transformation modifie la nature du noyau et
s’accompagne de l’émission de particules et de radiations électromagnétiques.
La désintégration d’un noyau est :
·
spontanée, (se déroule sans facteur déclenchant)
·
inéluctable, (se produira tôt ou tard mais de manière certaine)
·
aléatoire, (il est impossible de savoir à quel instant un noyau donné se
désintégrera)
VoirTP et animation : Caractère aléatoire de la radioactivité (TP)
·
indépendante des combinaisons chimiques dans lesquelles l’atome est engagé.
·
indépendante des conditions physiques (température T, pression p, champ
magnétique 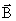 , champ électrique
, champ électrique 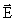 , état solide, état liquide, état gazeux …),
, état solide, état liquide, état gazeux …),
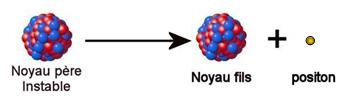
Un noyau « père » disparaît pour former un noyau
« fils » et du rayonnement (particules + radiations).
Loi de conservation :
Au cours d’une transformation nucléaire (spontanée ou non),
il y a conservation du nombre total de nucléons A et du nombre total de charges
électriques Z.
3.2.
Les différentes
radioactivités
3.2.1.
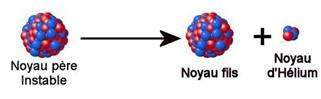
Radioactivité a
La radioactivité a correspond à l’émission de noyaux d’hélium 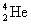 (autrefois appelés
rayons, ou particules, a avant la découverte de l’hélium) par certains noyaux.
Ce type de radioactivité concerne les noyaux présentant un excès de nucléons et
appelés « noyaux lourds » (A > 200).
(autrefois appelés
rayons, ou particules, a avant la découverte de l’hélium) par certains noyaux.
Ce type de radioactivité concerne les noyaux présentant un excès de nucléons et
appelés « noyaux lourds » (A > 200).
|
Équation générale : 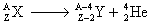
Exemple : 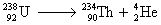
|
|
3.2.2.
Radioactivité b–
La radioactivité b– correspond à l’émission d’électrons
(autrefois appelés rayons, ou particules b avant la découverte de
l’électron) par certains noyaux. Ce type de radioactivité concerne les noyaux
présentant un excès de neutrons. Les noyaux radioactifs b– sont situés
au dessus de la vallée de stabilité.
|
Équation générale : 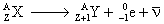
On omettra l’antineutrino 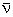 . .
Exemple : 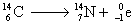
|
|
3.2.3.
Radioactivité b+
La radioactivité b+ correspond à l’émission de positrons (ou
positons) par certains noyaux. Les positrons sont les antiparticules des
électrons : toutes leurs propriétés sont identiques à celle des électrons
sauf leur charge électrique qui est opposée. Ce type de radioactivité concerne
les noyaux présentant un excès de protons. Les noyaux radioactifs b+
sont situés au dessous de la vallée de stabilité.
La radioactivité b+ existe surtout pour les nucléides artificiels
(préparés dans des réacteurs nucléaires ou dans les accélérateurs de
particules). Elle est extrêmement rare pour les nucléides naturels.
|
Équation générale : 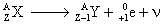
On omettra le neutrino 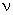 . .
Exemple : 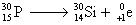
|
|
(historique : 1er
nucléide artificiel créé en 1934 par I. et F. Joliot-Curie)
3.2.4.
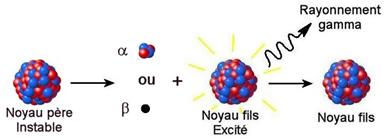
Désexcitation g
Si le noyau fils issu d’une désintégration radioactive a ou b est dans un état excité, l’excédent d’énergie est libéré sous forme de
rayonnement électromagnétique g de très haute fréquence (de l’ordre de 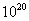 Hz).
Hz).
Un noyau dans un état excité est représenté avec un astérisque en
exposant à droite.
|
Équation générale : 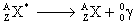
Exemple :
Associée à la radioactivité α
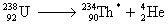
suivi de 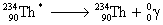
|
|
3.3.
Familles radioactives
La radioactivité entraîne la transformation d’un nucléide en un autre
nucléide. Si ce dernier est lui-même radioactif, il se transforme à son tour,
et ainsi de suite jusqu’à ce que le nucléide obtenu ne soit plus radioactif.
L’ensemble des nucléides obtenus à partir d’un même noyau père est
appelé famille radioactive.
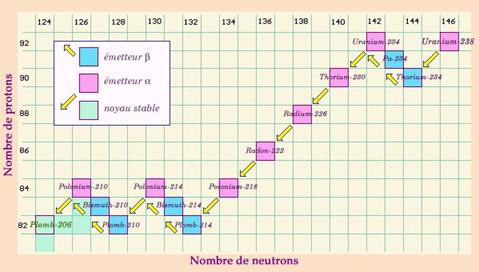
Il existe 4 familles radioactives : celle du Neptunium, celle de
l’uranium (cf ci-dessous), celle de l’actinium et celle du thorium.
Certains nucléides peuvent se désintégrer soit par radioactivité a soit par radioactivité 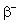 , comme le polonium 218 dans la famille de l’uranium.
, comme le polonium 218 dans la famille de l’uranium.