Corrections sujets chimie 2010

Correction

Rappels
utiles :
a/sur
les symboles utilisés dans les exercices:
-« c » désigne la concentration d’une solution c'est-à-dire la quantité
de matière de soluté introduite divisée par le volume
total de la solution (après introduction du soluté sans
tenir compte d’une éventuelle transformation de
ce dernier avec l’eau).
-« [CH3COOH]aq » ou « [CH3COOH]sol » désigne la
concentration du soluté restant dans la solution après réaction de ce
dernier avec l’eau.
Il ne faut évidemment par confondre ces
deux grandeurs !
b/
sur le nombre de chiffres significatifs :
En général deux chiffres sont à
prévoir !
Utiliser la notation scientifique
ex : c=1,0.10-1 mol.L-1.(la
notation c=10-1 n’est donc pas correcte)
. 1-L’acide éthanoïque CH3COOH est un acide faible. Sa
mise en solution dans l’eau conduit à l’équilibre chimique :
![]()
Cet
équilibre s’ajoute à l’équilibre d’autoprotolyse présent dans toute
solution aqueuse :
![]()
Inventaire
des espèces présentes : CH3COOH, CH3COO-,
HO-, H2O, H3O+
La
solution étant électriquement neutre, on doit avoir :
![]()
La
solution étant très acide, les ions HO- peuvent être négligés devant H3O+
![]()
Remarque : cette relation
indique que tous les ions H3O+ proviennent de la
dissociation de l’acide CH3COOH (équation 1). L’existence de
l’autoprotolyse (2) peut être négligée. Ce ne serait pas vrai si la solution
était très très diluée (c<10-6) :
voir le cours sur le sujet.
Et
de pH =2,9, nous tirons
![]()
La
conservation du groupe d’atomes CH3COO permet d’écrire :
![]()
Soit :
![]() Ce calcul montre que l’acide est très peu dissocié dans l’eau. On montre
que cette dissociation augmente lorsque la concentration c diminue.
Ce calcul montre que l’acide est très peu dissocié dans l’eau. On montre
que cette dissociation augmente lorsque la concentration c diminue.
La
constante d’acidité du couple CH3COOH/CH3COO-
vaut alors:
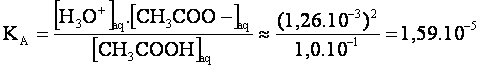
Et
donc : pKA=-logKA=-log(1,59.10-5)=4,8
2-Soit V2=20cm3,
le volume de la solution S2 de concentration 1,0.10-1
mol.L-1
Appelons
V’2 le volume a ajouter à S2
pour obtenir une concentration après dilution de : c3=2,0.10-3mol.L-1.
La
concentration de la solution acide après dilution est :

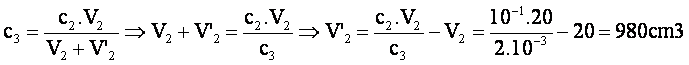
La
solution S3 a donc un volume total de 1,0L
3-
Illustrons la question posée par un schéma :
Appelons
V1 le volume de S1 à verser.
Un petit schéma est souvent utile pour
illustrer une question et mieux la comprendre
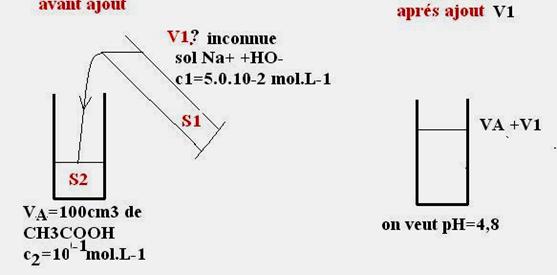
Lors
de l’ajout de S1, une réaction base forte /acide faible quasi-totale
se produit.
Pour
obtenir pH=4,8=pkA, il faut verser la
solution de soude jusqu’à la demie-équivalence de la réaction :
CH3COOH +
HO- à CH3COO- +
H2O
Il faut :

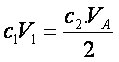
soit :
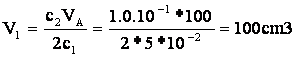

Correction :
1-
Quelques rappels de
cours:
Définitions
du pH :
pH
=-log[H3O+] et comme [H3O+] .[HO-]=KE=10-14
à 25°C (produit ionique de l’eau),
pH=14
+ log[OH-]à 25°C.
On
a aussi : [H3O+]=10-pH et en utilisant le
produit ionique de l’eau :
[OH-]=10-14/[H3O+]=10-14/10-pH=10(pH-14)
Si la base est forte, elle est intégralement
transformée en HO- dans l’eau :
[HO-]=c
et par conséquent : pH=14 + logc.
Au
contraire, pour une base faible : .[HO-]<c
et donc : pH<14 + logc
Dans
l’exercice 14+logc=14+log(10-2)=12>10,6.
L’ammoniac est une base faible.
2-Ecrivons
les équations des réactions dans la solution
-
dissociation dans l’eau de l’ammoniac :
![]()
-autoprotolyse
de l’eau :
![]()
Inventaire
des espèces présentes : NH3, NH4+, HO-,
H2O, H3O+
La
concentration des H3O+ est négligeable car la solution est nettement
basique.
On
a donc : [NH4+ ] =[OH-]=10(10,6-14)=10(-3,4)=4,0.10-4
mol.L-1.
La
conservation de la matière au cours de la dissociation permet d’écrire :
c = [NH4+
]aq + [NH3 ]aq.
D’où
[NH3 ]aq.=1,0.10-2-4,0.10-4=(100-4)10-4=9,6.10-3
mol.L-1.
3-Calculons
la constante d’acidité du couple NH4+/NH3 :
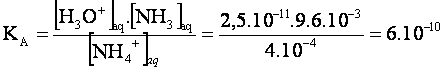
Soit
pkA=-logKA=-log(6.10-10)=9,2