Corrections
-rappel de l’énoncé :

-correction
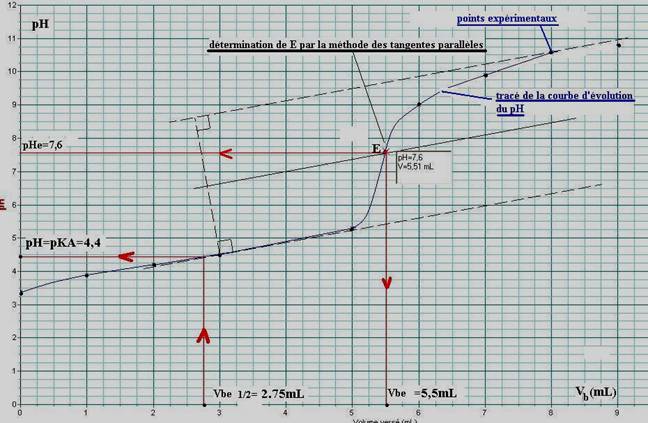
1-courbe
2-a/La base
conjuguée (ascorbate)
forme avec l’acide un couple tel que :
![]()
b/La méthode des
tangentes permet d’obtenir la position du point d’équivalence E(voir graphe ci-dessus).Repérons l’abscisse du point E,
soit Vbe=5,5mL puis l’abscisse du point de demi-
équivalence. Soit VBE1/2=2.75mL
Le pKA
du couple est égal au pH à la demi-équivalence soit sur la courbe pH=pKA=4,4
3-Concentrations à la
demi- équivalence :
Lors de l’ajout de HO-,
l’acide réagit totalement avec lui suivant la réaction :
![]()
A la demi-équivalence, la quantité de base ascorbate
formée est égale à la quantité restante d’acide ascorbique et leurs
concentrations sont aussi égales.
A l’équivalence, tous les ions HO- versés auront fait disparaître la
totalité des molécules d’acide ascorbique .Celles-ci seront transformées
intégralement en ions ascorbate.
Déterminons la
concentration apportée CA (avant ajout HO-) de la solution d’acide
ascorbique de volume VA=50cm3.
A l’équivalence :
![]()
Soit :CBVbe=CAVA
CA=CB.Vbe/VA=5,0.10-2*5,5/50=6,05.10-3mol.L-1.
A la
demi-équivalence :
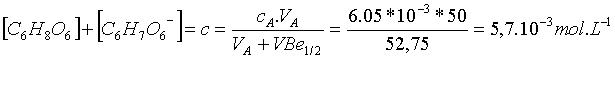
Attention !
La concentration « c » de la solution est alors différente de « cA » (concentration initiale) .c prend en
compte l’effet de dilution consécutif à l’ajout du volume de soude ajouté
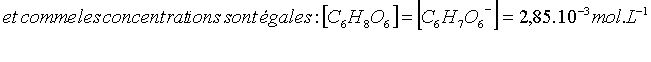
De
pH=4,4, nous tirons [H3O+]=10-4,4= 4.0.10-5mol.L-1.
Les
ions Na+ introduits par la solution de soude subissent une simple dilution,
soit :
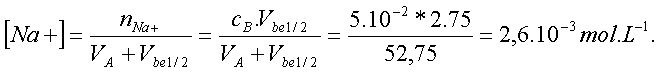
La concentration en HO-
est telle que :[H3O+].[HO-]=10-14.
[HO-]=10-14+4,4=10-9.6
= 2,5.10-10mol.L-1. Celle-ci est tout à fait négligeable.
-rappel énoncé : CHIMIE GENERALE Bac TC 2007 partiel (3 points)
Dosage d’un vinaigre
Une
bouteille de vinaigre porte l’indication
« vinaigre à 7° » ce qui correspond à 70 g d’acide éthanoïque par litre. Afin de vérifier cette indication, on prépare
une solution S diluée 10 fois à partir de ce vinaigre.
On réalise le dosage pH-métrique de 10 cm3 de cette
solution S par une solution de soude de concentration molaire CB = 10–1.mol. L–1 . Soit VB le volume de soude versé. On obtient
les résultats suivants :
|
VB(cm3) |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
11,5 |
12 |
13 |
14 |
15 |
|
PH |
3,35 |
3,7 |
4 |
4,15 |
4,3 |
4,5 |
4,7 |
4,8 |
5 |
5,25 |
5,5 |
6,2 |
8 |
9,9 |
10,8 |
11 |
11,15 |
1 - Tracer, sur le document A,
la courbe traduisant les variations du pH en fonction du volume VB
de soude versé. (1,00)
2 - Déterminer,
par la méthode des tangentes, les coordonnées du point d’équivalence ainsi que
le pKA du couple : CH3 –
COOH / CH3 – COO– . (1,00)
3 - Déterminer
la concentration molaire de la solution acide S. L’indication portée par l’étiquette est-elle exacte ? Justifier la réponse.
-correction :
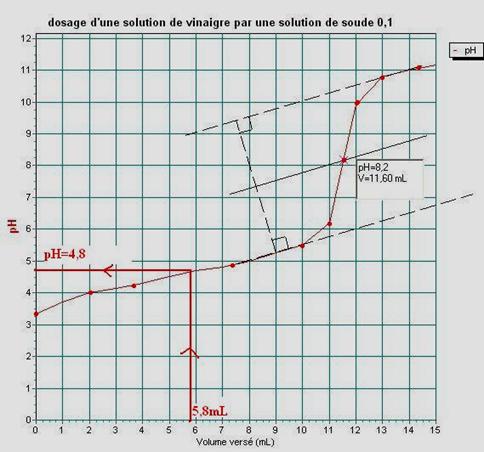
1-
tracé de la courbe (ici réalisé
avec la logiciel « dos A » inclus dans la médiathèque).
2-Les
coordonnées du point d’équivalence sont indiquées sur le graphe.
A
la demi-équivalence, pH=pkA=4,8
3-Concentration
CA de la solution diluée S :
Soit
VA, le volume initial de la solution S
A
l’équivalence,
![]()
Soit :
CA.VA=CB.VBE
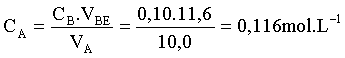
La solution mère de
vinaigre a donc une concentration Co=10.0,116 =1,16mol.L-1.
Or, 1,16mol de CH3COOH
représente une masse :
m=nCH3COOH.MCH3COOH=1,16.60=69,
6g de CH3COOH par litre de solution
L’indication de
l’étiquette est donc correcte.