Correction avec rappel de
l’énoncé

1-
Le
pH acide de la solution S1 résulte de l’introduction dans l’eau de
molécules HCl qui se transforment suivant le
bilan :
HCl
+ H2O à H3O+ + Cl-

Rappelons la définition de la concentration
de S1 :
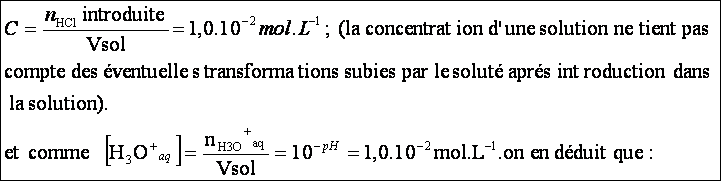
![]()
La réaction de HCl avec l’eau est donc totale ; HCl
est un acide fort.
Le pH acide de la solution S2 résulte de
l’introduction de molécules HCOOH qui se transforment au contact de l’eau, et
cette fois :
![]()
En
conséquence, la réaction de HCOOH avec l’eau est limitée, soit :
HCOOH + H2O ßà HCOO-
+ H2O
Et nous dirons pour cela que HCOOH est un acide faible.
2- Nous pouvons déterminer le pkA à partir de la relation :
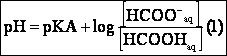
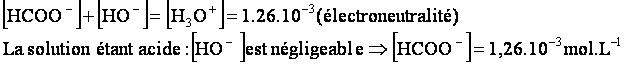
de plus:
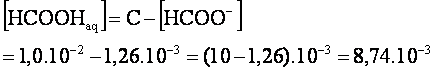
( conservation du groupement HCOO au
cours de la réaction )
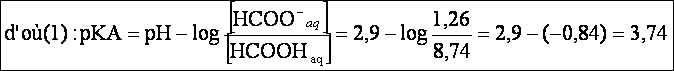
3-Détermination
des volumes d’eau V1 et V2 (voir schéma ci-dessous):
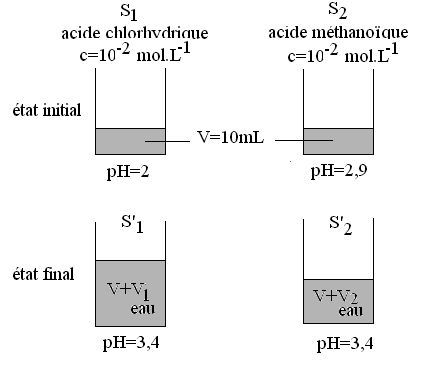
Calcul de V1 d’eau
à ajouter à S1:
A
l’état final (après ajout d’eau), il faut [H3O+]f =10-3.4=4.10-4
mol.L-1.
L’acide
étant fort, tous les ions H3O+ provenant de HCl sont libérés dans la solution initiale et leur quantité
de matière après dilution reste inchangée.
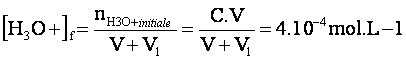
Avec
V=10mL et C=1,0.10-2mol.L-1 on tire : V1=240mL
Ce
qui fait un volume final V’1=V+V1=250mL
Calcul de V2
d’eau à ajouter à S2 :

L’acide étant faible, l’ajout d’eau déplace l’équilibre et par conséquent
la quantité de matière initiale est modifiée (elle augmente au cours de la
dilution).
Le raisonnement précédent ne convient plus.
Il
va falloir utiliser la relation (1) qui fait intervenir le pkA
(qui lui est invariant !).
Il
faut encore obtenir après dilution :[H3O+]f
=10-3.4=4.10-4 mol.L-1.
L’électroneutralité de la solution permet de calculer [HCOO-]
![]()
La
relation (1) permet de calculer :[HCOOH]aq .
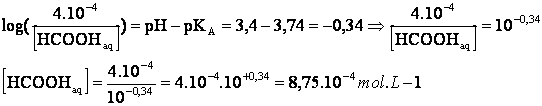
L’équation
de conservation de matière permet de calculer la nouvelle concentration c’(après dilution):
![]()
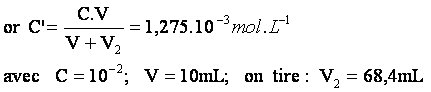
Le
volume final est donc V’2=V+V2=10+68.4=78,4mL