Méiose-fécondation: Brassages
STABILITÉ ET VARIABILITÉ DES GÉNOMES ET EVOLUTION
MEIOSE ET FECONDATION SONT A L'ORIGINE DU BRASSAGE GENETIQUE
Autant les individus issus du clonage d'une cellule d'un seul parent sont tous identiques, car ils reçoivent la totalité de l'équipement chromosomique de celui-ci, autant la reproduction sexuée produit des individus d'une extrême diversité. Voyons quels sont les rouages qui assurent cette variété.
1 Le comportement des allèles à la méiose:
1.1 LA REPARTITION DES ALLELES: UN CROISEMENT CHEZ SORDARIA
On croise une souche de Sordaria à spores blanches avec une souche à spores noires (le caractère couleur des spores est gouverné par un couple d'allèles (noir N ou blanc B).
![]()
![]()
![]()
![]() On dépose dans une boîte de Pétri quatre cubes de gélose couverts de mycélium de souches pures (deux à spores blanches, deux à spores noires) comme indiqué sur le schéma ci-dessous. On place la boîte de Pétri une dizaine de jours à l'étuve dans une atmosphère humide à 25°C.
On dépose dans une boîte de Pétri quatre cubes de gélose couverts de mycélium de souches pures (deux à spores blanches, deux à spores noires) comme indiqué sur le schéma ci-dessous. On place la boîte de Pétri une dizaine de jours à l'étuve dans une atmosphère humide à 25°C.
Des périthèces (fructifications) apparaissent aux endroits de jonction entre les filaments mycéliens.
Vous prélèverez délicatement un périthèce à l'aide d'une pince fine, que vous monterez dans une goutte d'eau entre lame et lamelle: vous écraserez légèrement la préparation pour étaler le périthèce.
Vous observerez le bouquet d'asques au microscope.
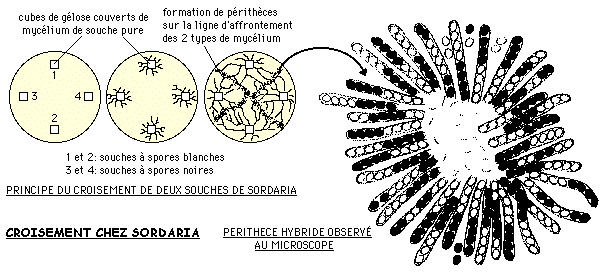
Les spores sont enfermées dans leur asque étroit et occupent donc ainsi la place dont elles héritent après les deux divisions de méiose et la mitose surnuméraire. De cette manière l'espace entre chaque spore figure le plan équatorial du fuseau de division après chaque télophase: la disposition des spores reflète la disposition des chromatides en fin de méiose et les événements qui ponctuent ce phénomène sont révélés par l'aspect des asques.
![]()
![]() Vous observerez les différents types d'asques. Vous en ferez des schémas et dans un bouquet vous évaluerez les proportions de chacun des types.
Vous observerez les différents types d'asques. Vous en ferez des schémas et dans un bouquet vous évaluerez les proportions de chacun des types.
Nous observons donc que la méiose a des conséquences sur la répartition des allèles: il s'agira d'expliquer cette répartition.
1.2 L'EXPRESSION DES ALLELES: LES GROUPES SANGUINS DU SYSTEME ABO
Chez les organismes haploïdes la relation entre génotype et phénotype est simple: pour un caractère gouverné par un gène, le phénotype correspond à l'unique allèle qui le détermine.
En revanche chez les organismes diploïdes le problème se pose de savoir quel phénotype résulte du génotype.
Pour presque tous les gènes, il existe plusieurs allèles apparus par mutations. Certains sont rares, mais pour d'autres gènes les allèles sont bien répandus dans la population. En ne considérant que ceux dont la fréquence dépasse 1%, on admet qu'un tiers des gènes, dans l'espèce humaine, sont polymorphes.
On estime par ailleurs que chaque personne possède deux versions alléliques différentes pour 7% des gènes environ (individu hétérozygote). Ce qui signifie que sur un total de 30 000 gènes du génome humain, chacun est hétérozygote pour 30 000 x 7% = 2 100 gènes. On est dit homozygote pour un gène donné si l'on possède deux allèles identiques de ce gène.
Les goupes sanguins ABO correspondent à la présence ou à l'absence de molécules appelées "marqueurs" à la surface des globules rouges (voir le chapitre "innovations génétiques" §1).
Une personne hétérozygote possédant à la fois l'allèle A et l'allèle O a les mêmes marqueurs de type A qu'un individu homozygote possédant deux allèles A. Le phénotype est qualifié de dominant.
Par contre le phénotype O correspond à la possession de deux allèles O: le phénotype est dit récessif.
La possession à la fois de l'allèle A et de l'allèle B, détermine les deux types de marqueurs sur les hématies: le phénotype AB est dit codominant.
![]()
![]() Dans un tableau vous résumerez les génotypes et les phénotypes (exprimés entre [...] résultant de l'expression de ces trois allèles A, B et O.
Dans un tableau vous résumerez les génotypes et les phénotypes (exprimés entre [...] résultant de l'expression de ces trois allèles A, B et O.
 Cas particuliers...
Cas particuliers...
Une dominance incomplète chez les Belles-de-nuit: l'allèle R gouverne la synthèse d'une substance colorée rouge, l'allèle B ne permet pas la synthèse de pigment: les fleurs restent blanches. Ainsi, l'hétérozygote R/B fabrique-t'il des fleurs roses.
![]()
![]() On réalise une fécondation croisée entre deux parents P de races pures (homozygotes). Sur les plants obtenus en F1 après germination des graines on laisse se réaliser l'autofécondation. Les fleurs obtenues en F2 répondent, en terme de phénotype et de proportions, au schéma ci-contre.
On réalise une fécondation croisée entre deux parents P de races pures (homozygotes). Sur les plants obtenus en F1 après germination des graines on laisse se réaliser l'autofécondation. Les fleurs obtenues en F2 répondent, en terme de phénotype et de proportions, au schéma ci-contre.
Interprétez les résultats obtenus en représentant l'échiquier de distribution des allèles en F2.
L'haplo-suffisance dans certaines maladies géniques comme la mucoviscidose: c'est une maladie génique récessive, dont le gène est porté par le chromosome 7 (maladie autosomale) et qui gouverne normalement la synthèse d'une protéine appelée CFTR (Cystic Fibrosis Transmembrane Regulator) qui permet les échanges d'ions Cl- au travers de canaux protéiques de la membrane plasmique. L'allèle muté aboutit à la production de molécules protéiques non fonctionnelles.
Chez les hétérozygotes S/m
S = sain (majuscule pour le caractère dominant)
et m = mucoviscidose (minuscule pour le caractère récessif)
la quantité de protéine CFTR produite par un seul allèle est suffisante pour permettre un fonctionnement normal. Alors que chez les homozygotes m/m, son absence se traduit par la sécrétion d'un mucus visqueux qui cause les problèmes respiratoires (obstruction des bronches) et digestifs que connaissent les malades.
Nous verrons dans le §2.2.2 suivant comment peuvent se distribuer les allèles dans une famille et comment connaître le génotype d'un individu.
2 Comment déterminer le génotype d'un individu?
2.1 LE CROISEMENT-TEST OU "TEST-CROSS":
 En zootechnie et en agronomie, il est intéressant de pouvoir sélectionner des individus de race pure pour un (ou des) caractère(s) donné(s), c'est-à-dire de trouver une technique permettant de distinguer des individus homozygotes d'individus hétérozygotes: c'est le croisement-test ou "test-cross". Voyons comment cela est possible chez la souris.
En zootechnie et en agronomie, il est intéressant de pouvoir sélectionner des individus de race pure pour un (ou des) caractère(s) donné(s), c'est-à-dire de trouver une technique permettant de distinguer des individus homozygotes d'individus hétérozygotes: c'est le croisement-test ou "test-cross". Voyons comment cela est possible chez la souris.
Le principe consiste à croiser un individu dont on ne connait pas le génotype avec un individu dont on est sûr du génotype: en l'occurrence ici, une souris au caractère récessif, le pelage blanc (albinos) par exemple.
Le schéma ci-contre exprime les résultats concernant les deux alternatives possibles.
![]()
![]() Dans les deux cas expliquez les résultats obtenus en dressant l'échiquier si nécessaire (l'observation d'un grand nombre de portées montre que dans la première alternative, le phénotype gris échoit à 100%, dans la deuxième alternative, les deux phénotypes gris et blancs sont équiprobables).
Dans les deux cas expliquez les résultats obtenus en dressant l'échiquier si nécessaire (l'observation d'un grand nombre de portées montre que dans la première alternative, le phénotype gris échoit à 100%, dans la deuxième alternative, les deux phénotypes gris et blancs sont équiprobables).
2.2 METHODES D'ANALYSE CHEZ L'HOMME:
Les croisements dirigés ne peuvent se concevoir chez l'homme. Il est donc nécessaire d'entrevoir d'autres méthodes pour connaître le génotype d'un sujet.
2.2.1 L'analyse d'arbres généalogiques:
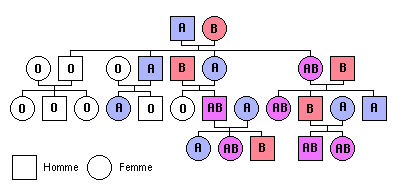 L'arbre ci-contre présente le groupe sanguin des membres d'une famille sur quatre générations.
L'arbre ci-contre présente le groupe sanguin des membres d'une famille sur quatre générations.
On considère qu'un seul gène détermine le groupe d'appartenance.
![]()
![]() Analyse de l'arbre dans le but de déterminer les hétérozygotes:
Analyse de l'arbre dans le but de déterminer les hétérozygotes:
1 - Dans tous les cas d'analyse d'un arbre généalogique, vous commencerez par déterminer, si le cas échoit, l'(es) allèle(s) récessif(s) et l'(es) allèle(s) dominant(s) en prenant bien en compte que la récessivité ne dépend absolument pas de la fréquence de l'allèle dans l'arbre. Pour ce faire, vous vous intéresserez plutôt aux couples dont les enfants n'ont pas le même phénotype que leurs parents.
2 - Vous observerez ensuite s'il existe une disproportion dans la répartition des phénotypes possibles entre les deux sexes:
- si oui, il pourra être envisagé une transmission par les chromosomes sexuels (gonosomie),
- sinon, et c'est le cas ici, puisque nous avons vu dans le §1 du chapitre "Innovations génétiques" que le gène gouvernant la dernière étape de la synthèse des marqueurs du système ABO est porté par le chromosome 9, la transmission se fait par autosomie.
3 - Procédez à la détermination du génonotype de chacun des membres. Des indéterminations peuvent se présenter.
2.2.2 L'électrophorèse au service du diagnostic:
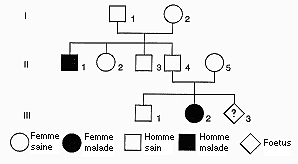 Nous avons envisagé, àla fin du §1, le cas de la mucoviscidose, maladie génique la plus fréquente du monde occidental (1 enfant sur 2 000 en est atteint). Elle se manifeste par des syndromes divers ayant tous en commun une concentration anormale en NaCl dans la sueur. La transmission autosomale se fait par l'intermédiaire du chromosome 7. En France, 2 millions de personnes sont hétérozygotes.
Nous avons envisagé, àla fin du §1, le cas de la mucoviscidose, maladie génique la plus fréquente du monde occidental (1 enfant sur 2 000 en est atteint). Elle se manifeste par des syndromes divers ayant tous en commun une concentration anormale en NaCl dans la sueur. La transmission autosomale se fait par l'intermédiaire du chromosome 7. En France, 2 millions de personnes sont hétérozygotes.
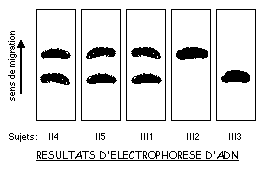
Des techniques, comme l'électrophorèse, permettent d'analyser l'ADN àpartir d'une goutte de sang par exemple. Un dépistage des hétérozygotes est ainsi rendu possible afin de permettre un diagnostic chez les familles àrisque. Dans une famille on relève les phénotypes ci-contre. Le couple II4 - II5 et ses trois enfants révèlent, lors d'une analyse de leur ADN codant pour le gène CF, dont la mutation est àl'origine de la maladie, les électrophorégrammes ci-dessous.
![]()
![]() Déterminez, à partir de l'arbre généalogique, le génotype des parents II4 et II5. Situez, dans un échiquier de croisement les deux enfants III1 et III2. Faites le lien entre ce que révèle l'analyse de l'arbre et ce que montrent les électrophorégrammes. Pouvez-vous apporter une réponse quant au risque encouru par le foetus III3 vis-à-vis de la mucoviscidose?
Déterminez, à partir de l'arbre généalogique, le génotype des parents II4 et II5. Situez, dans un échiquier de croisement les deux enfants III1 et III2. Faites le lien entre ce que révèle l'analyse de l'arbre et ce que montrent les électrophorégrammes. Pouvez-vous apporter une réponse quant au risque encouru par le foetus III3 vis-à-vis de la mucoviscidose?
3 Le brassage interchromosomique:
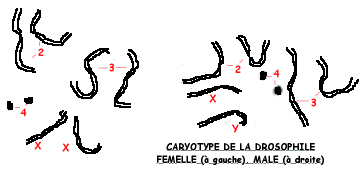
La Drosophile (Drosophila melanogaster) ou mouche du vinaigre est un matériel de choix en génétique dans la mesure ou sa petite taille facilite l'élevage dans des flacons de verre. Chaque accouplement produit des centaines d'individus et les générations se succèdent tous les 15 jours. De plus des mutations apparaissent spontanément, dont on peut augmenter la fréquence par traitement aux rayons X.
Leur garniture chromosomique est simple: 2n=8 et les mâles se distinguent des femelles par un chromosome Y et un chromosome X au lieu de deux chromosomes X.

ANALYSE D'UN CROISEMENT-TEST CHEZ LA DROSOPHILE:
 On considère deux caractères:
On considère deux caractères:
la couleur du corps avec les allèles "corps gris" (caractère sauvage désigné eb+) et "corps ébène" (caractère muté, récessif, désigné eb),
la longueur des ailes avec les allèles "ailes normales longues" (caractère sauvage désigné vg+) et "ailes vestigiales" (caractère muté, récessif, désigné vg).
Le croisement-test ci-contre est réalisé.
![]()
![]() En émettant l'hypothèse que les deux couples d'allèles sont situés sur deux paires de chromosomes homologues distincts, vous représenterez schématiquement l'équipement chromosomique de chacun des deux parents pour ces deux paires de chromosomes.
En émettant l'hypothèse que les deux couples d'allèles sont situés sur deux paires de chromosomes homologues distincts, vous représenterez schématiquement l'équipement chromosomique de chacun des deux parents pour ces deux paires de chromosomes.
Représentez ce qui peut se passer en anaphase de première et deuxième divisions de méiose lors de la formation des gamètes: montrez, en terme de probabilité, quel est le pourcentage d'échéance de chacun des types de gamètes pour chacun des parents.
Extrapolez ce résultat pour 3 paires de chromosomes, 4 paires (cas de la drosophile), 23 paires (cas de l'homme).
Réalisez l'échiquier de croisement pour le cas considéré.
Combien de cases comporterait-il si l'on croisait deux hétérozygotes entre eux pour 2, 3, ... n paires de gènes. Voyez-vous pourquoi l'on parle d'amplification du brassage réalisé à la méiose grâce à la fécondation?
Ainsi on parle de ségrégation indépendante des gènes lorsque ceux-ci sont situés sur des paires chromosomiques différentes: on reconnaît ce type de transmission héréditaire par l'équiprobabilité des combinaisons gamétiques réalisées à la méiose. C'est le brassage interchromosomique.
4 Le brassage intrachromosomique:
4.1 CHEZ SORDARIA
L'observation des asques résultant d'un croisement permet de visualiser directement les produits de la méiose (§1.1). Nous avons dénombré les types d'asques, nous allons à présent essayer d'expliquer la répartition des spores dans chacun d'eux.
![]()
![]() Sachant que Sordaria est un champignon haploïde et que la couleur des spores est gouvernée par un seul gène, schématisez l'équipement chromosomique des cellules du mycélium des deux souches parentales, de la cellule-oeuf après la fécondation.
Sachant que Sordaria est un champignon haploïde et que la couleur des spores est gouvernée par un seul gène, schématisez l'équipement chromosomique des cellules du mycélium des deux souches parentales, de la cellule-oeuf après la fécondation.
Afin d'expliquer la répartition 4 / 4, schématisez le comportement des chromosomes à la méiose, lors de la formation des spores.
Les répartitions 2 / 2 / 2 / 2 et 2 / 4 / 2 méritent une autre explication, dont les mécanismes ne peuvent que se produire en méiose, puisque, comme nous l'avons vu, les spores sont les cellules qui résultent directement de la méiose.
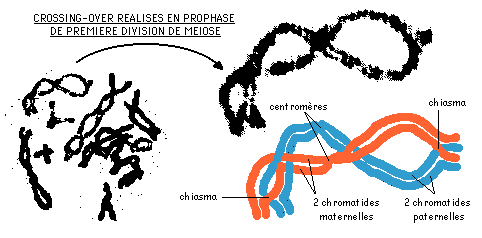 Au cours de la prophase de première division de méiose, lorsque les chromosomes sont à l'état de bivalents, il peut se produire des échanges de portions de chromatides entre chromosomes homologues (crossing-over): ces phénomènes sont visibles et portent le nom de chiasmas.
Au cours de la prophase de première division de méiose, lorsque les chromosomes sont à l'état de bivalents, il peut se produire des échanges de portions de chromatides entre chromosomes homologues (crossing-over): ces phénomènes sont visibles et portent le nom de chiasmas.
Le document ci-contre est réalisé à partir de l'observation microscopique de sacs polliniques d'étamines de lis.
![]()
![]() Vous ferez la même interprétation que ci-dessus pour l'une ou l'autre des répartitions 2 / 2 / 2 / 2 ou 2 / 4 / 2. Calculez, à partir du nombre d'asques de ce type, la probabilité d'échéance d'un crossing over.
Vous ferez la même interprétation que ci-dessus pour l'une ou l'autre des répartitions 2 / 2 / 2 / 2 ou 2 / 4 / 2. Calculez, à partir du nombre d'asques de ce type, la probabilité d'échéance d'un crossing over.
Ce type de brassage est appelé brassage intra-chromosomique.
4.2 ANALYSE D'UN CROISEMENT-TEST CHEZ LA DROSOPHILE:
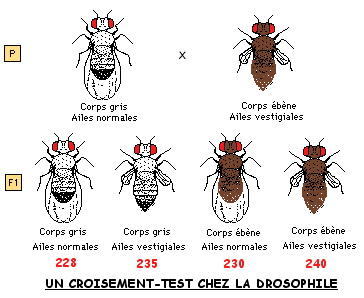
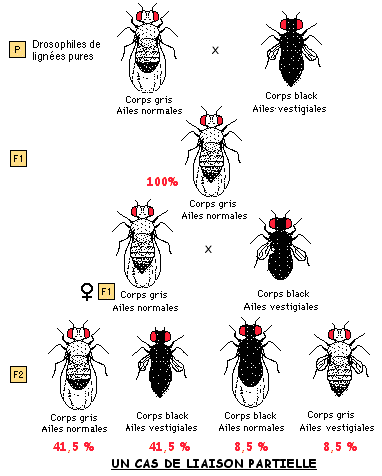 On croise des drosophiles de lignées pures (homozygotes) présentant les caractères suivants:
On croise des drosophiles de lignées pures (homozygotes) présentant les caractères suivants:
parents 1: corps "gris" et ailes "normales"
parents 2: corps "black" et ailes "vestigiales"
On obtient dans la première génération-fille 100% de drosophiles au corps "gris" et aux ailes "normales".
Des femelles de F1 sont croisées avec des mâles au corps "black" et aux ailes "vestigiales" (croisement-test). Les phénotypes et les proportions obtenus en F2 sont donnés dans le schéma ci-contre.
![]()
![]() Quelle déduction pouvez-vous faire de l'analyse des résultats de la génération F1?
Quelle déduction pouvez-vous faire de l'analyse des résultats de la génération F1?
Comme vous l'avez fait pour expliquer les répartitions 2 / 2 / 2 / 2 et 2 / 4 / 2 des spores de Sordaria, expliquez les phénotypes et la répartition des drosophiles de la génération F2.
Comparez ce croisement-test avec celui réalisé dans le §2: montrez en terme de représentation chromosomique les différences entre les deux.
Le brassage intra-chromosomique induit une recombinaison entre allèles: les gènes sont partiellement liés entre eux et les crossing-over rompent cette liaison en assurant une nouvelle répartition. Les phénotypes obtenus ne sont plus équiprobables, car la proportion de gamètes recombinés dépend du nombre de méioses pour lesquelles il s'est produit un crossing-over.