Réaction avec l'acide chlorhydrique
Chapitre 4 : Réaction entre les solutions de soude et d’acide chlorhydrique : Neutralisation
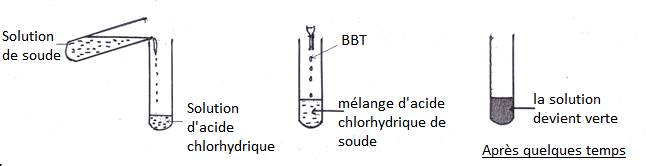
1- Expérience
Il y a une réaction entre une solution d’acide chlorhydrique et une solution de soude.
Le BBT introduit dans le mélange vire en vert après quelques temps, ce qui indique la fin de la réaction.
L’acide est neutralisé par la base : c’est une réaction de neutralisation.
2- Bilan de la réaction
Ecriture bilan
Acide chlorhydrique + hydroxyde de sodium → Chlorure de sodium + eau
Equation bilan ionique
(H+ + Cl-) + (Na+ + OH-) → (Na+ + Cl-) + H2O
1 mole 1 mole 1 mole 1 mole
Après le test, on constate la présence des ions Na+ et Cl- dans la solution ; ces ions n’ont pas réagi ; on dit qu’ils sont des ions spectateurs
Chapitre 5 : Réaction entre une solution d’acide chlorhydrique et les métaux :
Fer et Zinc
En général, il y a une réaction entre un acide et un métal avec formation de sel et dégagement de dihydrogène
Acide + métal → sel + dihydrogène
1- Réaction de l’acide chlorhydrique sur le fer
1.1- Expérience
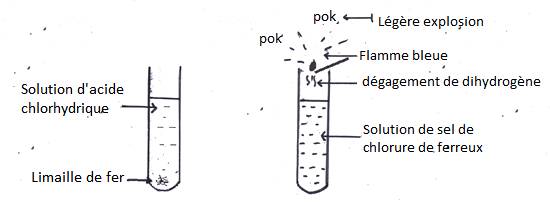
Si l’on traite à froid de limailles de fer par l’acide chlorhydrique, il se produit un vif bouillonnement dû au dégagement du dihydrogène qui, en le brûlant, donne une flamme bleue avec une légère explosion.
1.2 – Bilan de la réaction
Ecriture bilan
Acide chlorhydrique + Fe II → Chlorure de Fer II + dihydrogène
Equation ionique
2 (H+ + Cl-) + Fe → (Fe 2+ + 2Cl-) + H2
Equation globale
2HCl + Fe → FeCl2 + H2
2 moles 1 mole 1mole 1 mole
2- Réaction de la solution d’acide chlorhydrique sur le zinc
2.1- Expérience
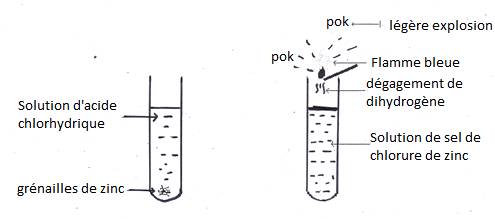
Si l’on traite à froid des grenailles de zinc par l’acide chlorhydrique, il se produit un vif bouillonnement dû au dégagement du dihydrogène qui, en le brûlant, donne une flamme bleue avec une légère explosion.
2.2- Bilan de la réaction
Ecriture bilan
Acide Chlorhydrique + Zinc → Chlorure de zinc + dihydrogène
Equation ionique
2 (H+ + Cl-) + Zn → (Zn2+ + 2Cl-) + H2
Equation globale
2HCl + Zn → ZnCl2 + H2
2 moles 1 mole 1 mole 1 mole

