Réaction entre le fer et le soufre
Chapitre 2 : RÉACTION ENTRE LE FER ET LE SOUFRE
1-Notion de réaction chimique
1.1 Définitions
La réaction chimique est une transformation au cours de laquelle, des corps disparaissent et d’autres nouveaux corps apparaissent.
Les corps qui disparaissent s’appellent REACTIFS.
Les corps qui apparaissent s’appellent PRODUITS.
1.2- Exemple : Combustion du carbone
Ecriture bilan de la réaction : Carbone + Dioxygène → Dioxyde de carbone (gaz carbonique)
Equation bilan de la réaction : C + O2 → C02
2- Réaction entre le fer et le soufre
2.1 Mise en évidence
a) Expérience
On brûle le mélange de limaille de fer et du soufre avec la flamme du bec Bunsen.
1) Expérience
|
|
Pesée du fer
|
|
Mélange
fer-soufre dans un mortier |
Sur une brique, on place le mélange |
|
|
|
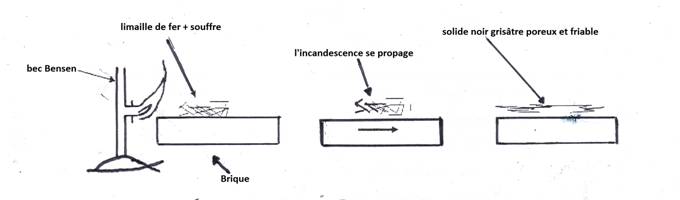
b) Résultats
L’incandescence se propage
On obtient un solide noir grisâtre poreux et friable, non attiré par un aimant. Ce solide est appelé sulfure de fer
c) Interprétation
Le produit obtenu (le solide noir) ne renferme plus de fer. C’est un nouveau corps
d) Conclusion
La réaction entre le fer sur le soufre donne le sulfure de fer de formule FeS.
2.2 Bilan de cette réaction
Ecriture-bilan
Fer + Soufre → Sulfure de fer
Equation bilan
Fe + S → FeS
1 mole de fer 1 mole de soufre 1 mole de sulfure de fer
Remarque :
-Le fer et le soufre disparaissent : ils sont les réactifs de cette réaction chimique. Le sulfure de fer apparaît, il en est le produit
- L’équation bilan doit être équilibrée
Exercice résolu 3
On fait réagir du fer sur du soufre pour obtenir du sulfure de fer.
1) Ecrire l’équation bilan de la réaction
2) Si on fait agir 56g de fer sur 35g de soufre,
a- Quelle sera le réactif en excès ?
b- Que deviendra l’excédent de ce réactif ?
c- Calculer la masse de sulfure de fer obtenu.
d- Calculer le nombre de moles de sulfure de fer obtenu.
e- Calculer le nombre de molécules du produit obtenu.
On donne : MFe = 56g.mol-1 ; MS =32g.mol-1 ; NA = 6,023.1023 mol-1.
Solution
1) Equation bilan : Fe + S → FeS
2)
a) d’après cette équation bilan, pour obtenir 1 mol de FeS, 56g de fer et 32g de soufre seulement ont réagi.
Par conséquent, si on mélange 56g de fer avec 35g de soufre, le réactif excédent est le soufre.
b) Deux cas peuvent se produire pour l’excédent de ce réactif :
1er cas : si la combustion continue, le soufre réagit avec le dioxygène de l’air pour donner du gaz SO2.
2ème cas : si la combustion d’arrête, le soufre en excès reste à l’état pur.
c) Masse du sulfure de fer obtenu :
m = 56 +32 = 88g
d) Nombre de moles de sulfure de fer obtenu :
La masse molaire moléculaire du sulfure de fer est 88g.mol-1,
Or on a obtenu m = 88g de FeS, cette mole de molécules contient 1x 6,023.1023 molécules de FeS
On a obtenu alors 6,023.1023 molécules de FeS




