Les édifices chimiques
I- objectifs :
-présenter les édifices chimiques à structure ionique et moléculaire.
-mettre en évidence la « règle de construction » de ces édifices : la règle dite de « l’octet et du duet ».
-décrire la structure électronique de quelques molécules.
II-La stabilité des gaz rares :
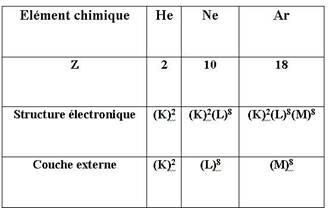
Les gaz rares : hélium, néon, argon, krypton, xénon et radon sont les seuls gaz formés d’atomes isolés (gaz monoatomiques) .Ils sont chimiquement inertes et donc particulièrement stables. L’examen de leur structure électronique montre que leur dernière couche électronique est complète ou saturée. (voir tableau ci-dessous)
III- L’instabilité des autres atomes isolés :
Les autres atomes isolés ne peuvent exister que de façon transitoire. Ils doivent se transformer pour se stabiliser. Ils peuvent le faire de plusieurs façons :
-Soit en perdant ou en gagnant des électrons pour devenir des ions.
-Soit en s’assemblant entre eux pour former des molécules.
IV-Enoncé de la règle de l’octet et du duet :
Les atomes isolés doivent en général se transformer pour acquérir la configuration électronique du gaz rare le plus proche dans la Classification Périodique, c'est-à-dire soit un octet ou soit un duet d’électrons.
(Cette règle présente néanmoins quelques exceptions que nous n’étudierons pas.)
V-Un exemple de structure ionique le chlorure de sodium :
a- une façon de préparer du chlorure de sodium par voie chimique :
Préparons d’abord un flacon de gaz dichlore.
Le dichlore est un gaz verdâtre stable mais toxique pour les bronches. Il faut éviter de le respirer.Il est formé de molécules Cl2. possédant chacune 2 atomes de chlore.
Les manipulations avec ce gaz doivent être réalisées sous une hotte.
Celui-ci peut être facilement obtenu par réaction chimique entre l’eau de javel et l’acide chlorhydrique. Un tube de dégagement permet de recueillir le gaz dans un flacon.
Le gaz plus lourd que l’air tombe facilement dans le fond du flacon. Boucher ce dernier.
Le sodium est un métal mou formé d’atomes de sodium Na. Il est particulièrement instable et doit être pour cette raison stocké à l’abri de l’air dans l’huile. Il peut s’enflammer spontanément dans l’air et dans l’eau.
Poser un petit morceau de sodium dans un creuset suspendu comme l’indique la figure ci-dessous, le chauffer dans l’air avec un bec bunsen, retirer le bouchon du flacon et l’introduire dans le flacon.
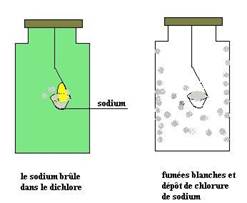
Le métal sodium brûle vivement dans le gaz dichlore avec une flamme jaune caractéristique.
La couleur verdâtre du dichlore disparaît peu à peu, des fumées blanches apparaissent et se condensent sur les parois : c’est du chlorure de sodium.,
b-Interprétation :
La transformation chimique peut se résumer par l’équation :
2Na(s) +Cl2(g)--> 2NaCl(s).
Ce que ne dit pas le symbole NaCl c’est que le chlorure de sodium est un composé ionique formé des ions Na+ et Cl-.
La transformation entre espèces chimiques peut être schématisée comme suit :
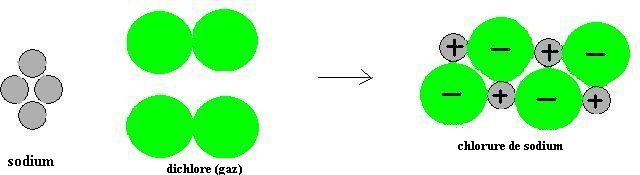
Analysons les transformations subies par les atomes intervenant dans la réaction.
Les atomes Na et Cl se transforment suivant les schémas :
Na Na+ + e- et Cl + e- Cl-
Etudions plus en détail ce qui est modifié au niveau des couches électroniques de chacun d’eux
c-observations :
Seuls les électrons de la couche externe sont concernés par la transformation.
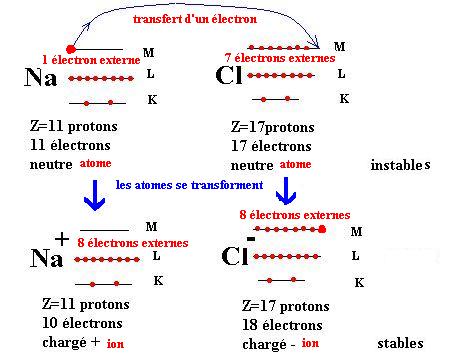
En se transformant chaque atome acquiert la configuration électronique du gaz rare le plus proche dans la Classification avec 8 électrons externes soit un octet d’électrons
Ainsi Na+ a 8 électrons externes et 2 couches occupées, il a même structure électronique que le Néon.
Cl- a 8 électrons externes et 3 couches occupées, il a même structure électronique que l’Argon.
d-Les ions monoatomiques stables :
Ils comportent sur leur couche électronique externe un duet d’électrons si l’élément a un numéro atomique Z proche de l’hélium, ou un octet pour les autres.
Quelques exemples sont donnés dans le tableau ci-dessous :

Remarque : pour obtenir l’ion monoatomique le plus stable d’un élément, il suffit de déplacer (ajouter ou ôter) le moins d’électrons possibles à l’atome correspondant .Par exemple, il faut retirer les 3 électrons externes de la couche (M) de l’atome d’aluminium Al (et non ajouter 5 électrons sur cette couche M) pour obtenir l’ion aluminium.
VI Les édifices moléculaires :
1-La molécule de dihydrogène H2:
Un atome d’hydrogène H isolé {Z=1 ;(K)1} n’est pas stable .En effet son unique couche ne contient qu’ un électron.
Pour se stabiliser et « ressembler » à l’hélium, il a besoin d’un électron supplémentaire.
Deux atomes d’hydrogène peuvent se stabiliser ensemble en mettant en commun leur unique électron.
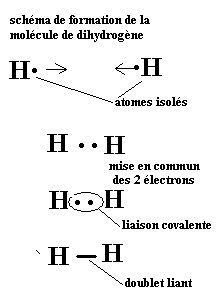
Les deux électrons ainsi appariés appartiennent à l’un et à l’autre atome. Chaque atome H est alors entouré de deux électrons et prend ainsi la configuration de l’hélium .La règle du duet est alors satisfaite. L’édifice stable obtenu est une molécule de dihydrogène H2.
Cette mise en commun de deux électrons qui apporte la stabilité de l’édifice s’appelle une liaison covalente. On dit aussi que les deux électrons mis en commun forment un doublet liant.
Un doublet liant est représenté par un trait plein entre deux atomes.
2- La molécule d’eau :
L’atome d’oxygène O{Z=8 ;(K)2(L)6}comporte 6 électrons externes, il doit donc en trouver deux autres pour compléter sa couche externe à 8 et obtenir la configuration électronique du néon ( la règle de l’octet doit s’appliquer pour lui) .
Deux atomes d’hydrogène peuvent chacun en apporter un et réaliser 2 liaisons covalentes ou deux doublets liants avec l’unique atome d’oxygène. D’où la formule H2O.
Il reste 4 électrons non engagés dans les liaisons qui appartiennent en propre à l’atome d’oxygène. Ces derniers forment deux doublets non liants représentés chacun par un trait plein autour de l’oxygène.
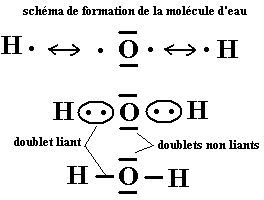
Cette représentation de la molécule porte le nom de son inventeur : c’est la formule de Lewis
Le symbole H2O est la formule brute de l’eau, elle indique les noms des atomes et leur nombre. La formule de Lewis indique en plus l’enchainement des atomes et la répartition des électrons externes de la molécule.
Cette dernière s’établit simplement en respectant les règles du duet et de l’octet pour chaque atome. Autre intérêt :la formule de Lewis permet en plus de prévoir sa géométrie .
3-valence d’un élément chimique:
Cette notion n’est pas indispensable mais facilite la recherche de la structure de la molécule.
La valence d'un élément chimique est le nombre maximal de liaisons covalentes qu'il échange dans une molécule. Celle-ci est bien entendu en accord avec la règle de l’octet et du duet.
Ainsi pour satisfaire la règle, l’atome d’oxygène doit échanger deux liaisons avec ses voisins, il est bivalent. Les atomes d’hydrogène et de chlore doivent échanger une seule liaison, ils sont monovalents.
Remarquer que la valence est égale au nombre d’électrons que l’atome doit gagner pour compléter sa couche externe.
On vérifiera ainsi que l’atome de carbone est tétravalent, l’atome d’azote est trivalent.
Dans le cas d’un ion monoatomique, la valence est égale à la charge de l’ion, on parle alors « d’électrovalence »
La couche de valence est la dernière couche électronique d'un atome (couche externe)
4-méthode systématique d’écriture de la formule de Lewis à partir de la formule brute:
Pour traiter des cas plus complexes, nous suggérons d’utiliser cette méthode :
A-Ecrire la structure électronique de chaque atome.
B- En déduire le nombre total N d’électrons externes dans la molécule et le nombre total de doublets d’électrons (liants et non liants) : soit N/2.
C-Déterminer le nombre de doublets liants que doit établir chaque atome avec ses voisins, ce nombre correspond à la valence de l’élément.
D-Réaliser l’enchainement des atomes : placer de préférence les atomes de valence la plus élevée (C, N, O..) en milieu de chaine etles atomes monovalents (H, Cl, F..) aux extrémités.
Attention il peut y avoir plusieurs enchainement possibles donc plusieurs molécules différentes (appelées isomères).
E-Distribuer les doublets liants entre les atomes liés en respectant la valence.
F –Placer les doublets non liants sur les atomes afin que les règles de l’octet et du duet soient satisfaites pour chacun d’eux.
Exemple : établir la formule de Lewis de l’acide formique de formule brute H2CO2.
H{Z=1 ;(K)1} ; C{Z=6 ;(K)2(L)4 ; O{Z=8 ;(K)2(L)6} (en rouge les électrons externes)
N=1*2+4*1+6*2 =18 soit N/2 =9 doublets liants et non liants.
Valences : H monovalent, C tétravalent, O bivalent
Enchainement :
Il faut obligatoirement 4 doublets liants autour de C, 2 doublets liants autour de O et un seul autour de H (ces derniers seront donc placés aux extrémités de la chaine)
H-C-O-O-H ne convient pas car la valence 4 du carbone n’est alors pas respectée.

Pour approfondir la méthode précédente, cliquer sur le lien
Méthode pour établir la formule de Lewis (diaporama)
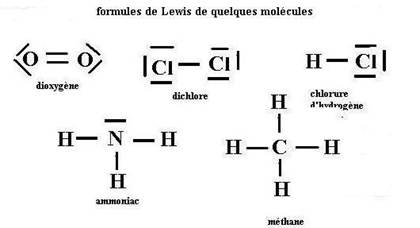
5-quelques autres molécules souvent rencontrées :
6-Molécules isomères :
Traitons l’exemple suivant : donnons la formule de Lewis de la molécule de formule brute :C2H7N.
Structures électroniques des atomes :H{Z=1 ;(K)1} ; C{Z=6 ;(K)2(L)4 ; N{Z=6 ;(K)2(L)5 ;
N=2*4+7*1*1*5=20 nombre de doublets : 10.
Nombre de doublets liants autour de chaque atome (ou valence) 1 pour H ; 4 pour C ; 3 pour N .
Il ya deux enchainements possibles :
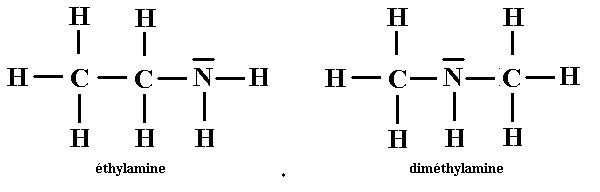
Deux molécules qui ont la même formule brute mais des représentations de Lewis différentes sont des isomères.
Les isomères ont des propriétés physiques et chimiques différentes.