Les modèles historiques de l'atome
A la recherche d’un modèle de l’atome
L’expérience de Rutherford et le modèle planétaire (1909)
Article rédigé par D. Bousquet, M. Delcey, P. Perrodin et D. Pilard (élèves en M1 à l'ENS Ulm), édité par N. Lévy, responsable scientifique du site CultureSciences-Chimie.
10 mai 2009
1. Présentation
L’idée de l’atome est très ancienne; elle est proposée pour la première fois par Démocrite entre -460 et -370 avant J.C. Il définit l’atome comme la plus petite partie insécable d'un corps simple.
Il faudra cependant attendre le XIXème siècle, avec notamment J. Dalton et A. Avodagro pour que l'atome passe d'un concept philosophique à un concept scientifique. Ce n'est qu'au début du XXème siècle que l'on aura les moyens techniques pour sonder la matière à l'échelle subatomique et construire un modèle de plus en plus élaboré.
2. Contexte scientifique
La notion d'électron, ou "atome d'électricité", est posée par G. Stoney. La démonstration expérimentale ainsi que la caractérisation de cette particule viendront avec J.J. Thomson. Celui-ci prouve que la matière est constituée de lourdes parties positives et d'électrons, parties négatives plus légères, pour lesquelles il arrive à déterminer la charge et la masse.
J.J. Thomson entrevoit ainsi la notion d'atomes sécables. Pour respecter la vision classique de la matière continue, il propose le modèle du "plum-pudding".

Il imagine que les électrons, le "plum" se déplacent dans un milieu chargé positivement : le "pudding".
La découverte, dans le même temps par H. Becquerel de la radioactivité, est une étape décisive. En effet, E. Rutherford, ancien élève de J.J. Thomson, se lance dans ce nouveau domaine et identifie les rayonnements α et β, en les distinguant selon leur pénétrabilité. Il montre que la radioactivité α émet des particules : des noyaux d'Hélium.
3. L'expérience de Rutherford et la découverte du noyau :
Pour étudier plus précisément le rayonnement α, E. Rutherford propose en 1909 de bombarder une feuille d'or extrêmement mince avec ces particules en plaçant un écran de détection tout autour de la feuille d'or (voir ci-dessous).
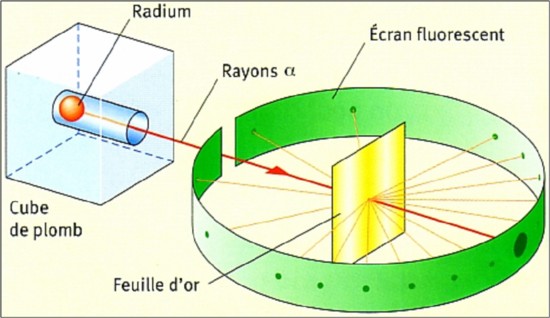
Le scintillement lumineux observé sur l'écran permet de visualiser la collision par les particules α. Au lieu de la répartition statistique gaussienne attendue avec la théorie du "plum-pudding", l'expérience montre que la plupart des particules traversent la feuille d'or sans déviation. E. Marsden et H. Geiger découvrent en affinant cette technique qu’une proportion infime des particules α (1 sur 8000)sont déviées avec un angle supérieur à 90°
Cette expérience met en évidence le caractère lacunaire de la matière et montre que les charges positives de l'atome sont fortement localisées dans l'espace. E. Rutherford propose alors un modèle en accord avec cette observation : le modèle planétaire(voir ci-dessous).
Il postule une représentation lacunaire de la matière où les électrons sont se meuvent autour d'un noyau de très petite taille et donc très dense et chargé positivement.
Pour voir une animation sur cette célèbre expérience et bien la comprendre, cliquer sur le lien ci-dessous :
Animation sur l'expérience de Rutherford
4. Critiques et perspectives
Cependant ce modèle n'est pas en accord avec les lois de l'électromagnétisme. En effet, l'électron sur son orbite est radialement accéléré et devrait donc rayonner selon la loi de Larmor. Ceci impliquerait une perte de l'énergie totale de l'électron, qui s'écraserait alors sur le noyau. L’atome ne serait pas un édifice stable.
De plus, ce modèle n'explique absolument pas la série des raies de Balmer du spectre de l'hydrogène.
N. Bohr propose alors, en s'inspirant des travaux de M. Planck, que le moment cinétique de l'électron est un multiple entier de h. Ainsi l'électron ne peut rayonner car on lui impose une énergie sur une orbite donnée. Ce modèle, qui règle le problème de l'instabilité du modèle planétaire, permet également de retrouver la série de Balmer.
Par la suite, le modèle de Bohr sera justifié par la mécanique quantique dans le cas particulier des hydrogénoïdes (atomes H et ion H+) Il n'est pas valable dans les autres cas, car N. Bohr postulait une orbite sphérique.
Les problèmes posés par le modèle planétaire de Rutherford font état de l'impossibilité de modéliser l'atome de manière satisfaisante grâce à la mécanique classique. Néanmoins, la mécanique quantique restant obscure pour le plus grand nombre, le modèle planétaire demeure la représentation traditionnelle dans l'imaginaire populaire.