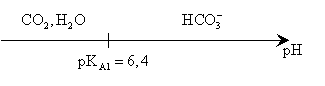
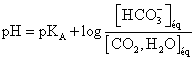T C TD |
titrages acidobasiques |
C 6 TP |
Compte rendu
Source : Lydie Germain, lycée Clémenceau, Reims
Titrage du vinaigre
Questionnaire 1 :
1°/ Calculer la concentration en acide
éthanoïque d’un vinaigre à 6°. (La densité du vinaigre est d » 1).
Si la densité vaut 1, la masse d’un litre de vinaigre est
égale à ![]() .
.
La concentration en acide éthanoïque du vinaigre est
![]() .
.
![]() .
.
2°/ Pourquoi ne peut-on pas titrer directement,
par pH-métrie, l’acide éthanoïque contenu dans ce vinaigre ?
On ne peut pas titrer directement par pH-métrie des
solutions dont les concentrations sont supérieures à ![]() (dans la pratique on évite de doser des solutions de
concentration supérieures à
(dans la pratique on évite de doser des solutions de
concentration supérieures à ![]() ), car les limites de mesures des électrodes sont
atteintes.
), car les limites de mesures des électrodes sont
atteintes.
Questionnaire 2 :
3°/ Écrire l’équation de la réaction de dosage.
.
![]()
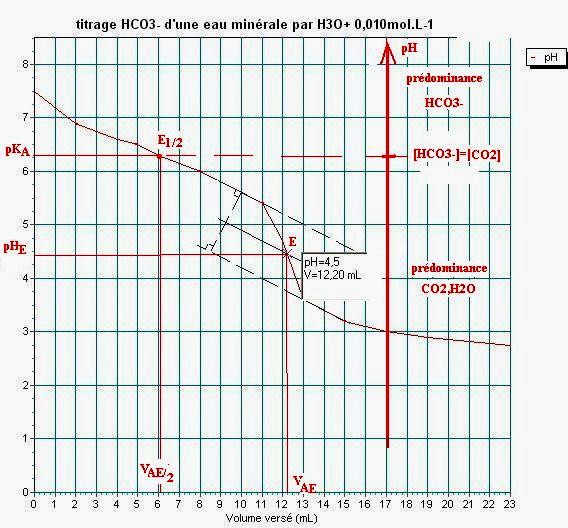
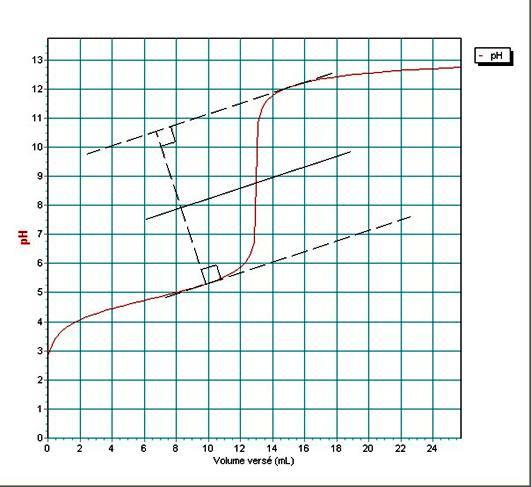
4°/ Déterminer le point d’équivalence
sur les deux courbes en rappelant les méthodes utilisées.
Méthode des
tangentes pour la courbe ![]() .
.
Le point
d’équivalence se trouve à VBE=12,8mL et pH » 8,7.
5°/ Calculer la concentration ![]() en acide éthanoïque du vinaigre.
en acide éthanoïque du vinaigre.
![]() et
et ![]() donc
donc
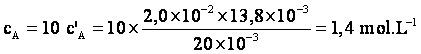 .
.
6°/ En déduire le degré d’acidité
du vinaigre. Vérifier l’indication de l’étiquette de la bouteille.
Le degré d’acidité
d’un vinaigre est la masse d’acide acétique pur contenu dans
Si le densité du
vinaigre vaut 1,
La quantité d’acide
éthanoïque dans ce volume est ![]()
La masse d’acide éthanoïque dans ce volume
est ![]()
et cela correspond
au degré d’acidité du vinaigre.
A.N. : ![]()
Cette valeur est
proche de l’indication de l’étiquette 8°.
7°/ Quel est le meilleur indicateur
coloré pouvant convenir pour réaliser ce dosage ?
Le pH à l’équivalence est 8,7, cette valeur doit être incluse dans la zone de virage de l’indicateur coloré.
On choisit dons la phénolphtaléine.