TP Dosage d’un produit du commerce à base de
soude
1-OBJECTIFS :
Vérifier la
validité de l’indication de l’étiquette d’un produit de nettoyage à base
d’hydroxyde de sodium (soude) NaOH.
Donner quelques informations sur les techniques
expérimentales (dilution, dosage).
Faire un choix raisonné du matériel de verrerie à utiliser compte tenu de
la précision demandée
Respecter les précautions de
sécurité.
L’étiquette
du produit mentionne les renseignements suivants :
PRODUIT
HARPIC Soude
caustique : 10%
d=1,03
|
|
|||||
|
|
|||||
|
|
|||||
Le produit provoque des brûlures au contact de la
peau. Verser dans l’eau avec précaution .
Ne pas laisser ce produit à portée des enfants.
2-ELABORATION D’UN PROTOCOLE EXPERIMENTAL:
Matériel disponible :
pH mètre , indicateur colorés (phénolptaléïne,
Bleu de bromothymol, Héliantine…).
Verrerie : pipettes de 1,0mL , 2,0mL, 10,0mL, 20,0mL , pipeteur.
Fioles :50, 100, 250mL,1000mL.
Agitateur
magnétique, béchers, verre à pied,
burette de 25mL.
Solutions titrantes préparées
à l’avance d’acide nitrique: HNO3 : cA=1,0.10-2,
2,0.10-2, 5,0.10-2 mol.L-1.
On réalisera
si possible le dosage en versant le contenu d’une seule burette sans faire l’appoint de solution titrante.

![]()
Questionnaire 1 : protocole à
réaliser
Proposer un protocole
d’expérience réalisable avec la verrerie et les solutions proposées ci-dessus. Faire les calculs nécessaires pour justifier les choix de matériel .
On donne MNaOH=40,0 g.mol-1
3-DILUTION DE LA SOLUTION
COMMERCIALE :
Etape 1 : préparation de la
verrerie et du matériel nécessaires à la dilution:
Mettre des
gants et se protéger les yeux avec des lunettes.
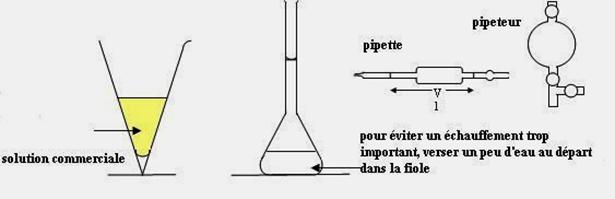
Verser 10mL environ de solution
commerciale dans un verre à pied.
Etape 2 : dilution de la
solution commerciale :
-On désignera par C0 la
concentration de la solution commerciale, v0 le volume de solution
commerciale à prélever et par cB la
concentration de la solution après dilution.
![]()
Questionnaire
2 : mise en œuvre de la dilution
-Avec le matériel choisi décrire toutes les
opérations à réaliser (étape 2) pour diluer la solution commerciale par 100
(CB=co/100)
-Pourrait-on remplacer la
pipette par une éprouvette graduée pour mesurer le volume v0 ?
Justifier.
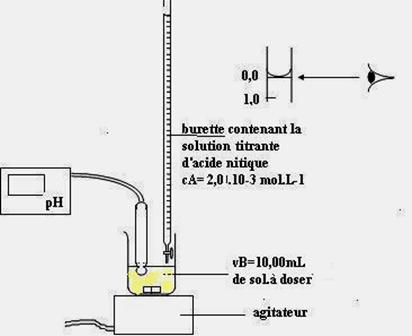
3-MISE EN ŒUVRE DU DOSAGE
SUIVI AU PH-METRE
Il faut maintenant mesurer la
concentration CB .de la solution diluée avec le matériel classique
de dosage (fig ci-dessous)
Prélever VB=10,0mL de
solution diluée mesurés avec une pipette
et verser son contenu dans un bécher de
capacité 100mL environ.
Poser le bécher sur un agitateur.
Placer un récipient
« poubelle » sous la burette et remplir cette dernière avec une
solution titrée d’acide nitrique de
concentration CA=2,0 .10-2 mol.L-1. Faire le zéro
de la burette.
Remplacer le récipient poubelle par
le bécher contenant les 10,0mL de solution diluée à doser.
Verser la solution « titrante» progressivement et mesurer le pH tout en agitant
la solution.
![]()
Collecter
les résultats dans le tableau :
|
VA (mL) |
0 |
5 |
7 |
|
|
|
|
|
|
|
|
|
|
|
|
25 |
|
pH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4-TRACE DE LA COURBE DE
DOSAGE ET DETERMINATION DE
L’EQUIVALENCE ;
En l’absence de pH mètre, on
trouvera ci-dessous les valeurs du pH obtenues par un groupe d’élèves et
un logiciel ci-dessous qui permet d’obtenir un tracé rapide de la courbe.
![]()
Cliquer alors sur le lien :.
Logiciel de tracé
des courbes pH métriques
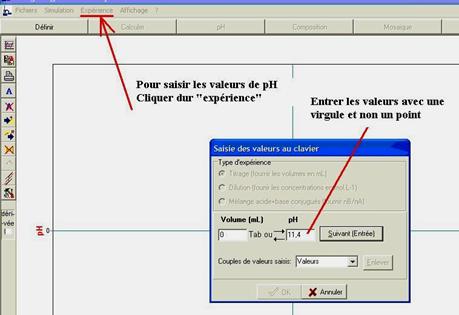
Sélectionner « expérience » ,
une boîte de dialogue intitulée « saisir les valeurs au clavier »
apparaît
ATTENTION ! Entrer les valeurs
avec décimales en utilisant la virgule et non le point
En cas d’erreur de saisie,
corriger les valeurs avant de valider le
tableau !
Le graphe se trace en appuyant sur
« OK »
Tracer le point d’équivalence en
utilisant la méthode des tangentes.
![]()
Questionnaire
3 :détermination
de la concentration de la solution commerciale
-Ecrire l’équation de la réaction de dosage.
-Définir l’équivalence de cette réaction.
-Déterminer le volume équivalent VAE
-En déduire la concentration cB de la solution diluée puis celle de la
solution concentrée Co.
-Le dosage peut être réalisé avec un
indicateur coloré , faire le choix de ce dernier.
Justifier.
-Calculer le pourcentage massique de soude
dans le produit. Comparer le résultat avec l’étiqiuette.
Valeurs du pH en fonction du volume
de solution titrante :
|
VA (mL) |
0 |
5 |
7 |
8 |
9.5 |
10 |
10.5 |
11 |
11.2 |
11.4 |
11.6 |
12 |
12.5 |
13 |
15 |
20 |
25 |
|
pH |
12.4 |
12,0 |
11.9 |
11.7 |
11.5 |
11,4 |
11,3 |
11.1 |
11.1 |
11.1 |
10,9 |
10,65 |
4,55 |
3,3 |
2.7 |
2.3 |
2,15 |