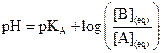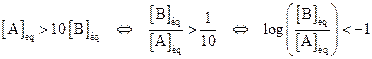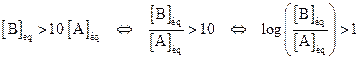|
TC/TD
|
réactions acido-basiques en solution aqueuse
|
|
Auteur : Lydie Germain,lycée Clémenceau, Reims http://fizik.chimie.lycee.free.fr
|
Objectifs :
|
Savoir que Ke
est la constante d’équilibre associée à l’équation d’autoprotolyse de l’eau.
Connaissant la valeur du pH
d’une solution aqueuse, dire si elle est acide, basique ou neutre.
À partir de la
concentration molaire des ions 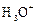 ou ou 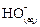 , déduire la valeur du pH de la solution. , déduire la valeur du pH de la solution.
Associer la constante
d’acidité KA à l’équation de la réaction d’un acide sur l’eau.
Déterminer la constante
d’équilibre associée à l’équation d’une réaction acido-basique à l’aide des
constantes d’acidité des couples en présence.
Connaissant le pH d’une
solution aqueuse et le pKA du couple acide/base, indiquer l’espèce
prédominante ; application aux indicateurs colorés..
|
Intro : une solution contenant un acide a-t-elle toujours
un pH inférieur à 7 ?
1.
Autoprotolyse de l’eau
1.1.
Le pH de l’eau pure
L’eau pure contient des ions
oxonium car, comme son pH = 7 à 25°C, 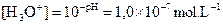 .
.
Ces ions présents en très
faible quantité ne peuvent provenir que des molécules d’eau. En effet, l’eau
est un ampholyte (amphotère) et elle intervient dans deux couples acide/base
différent. L’acide « eau » peut réagir avec la base « eau »
selon l’équation : 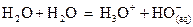 .
.
Cette réaction consistant en
un transfert de proton d’une molécule d’eau à une autre est appelée
autoprotolyse de l’eau.
À 25°C, on a donc 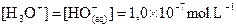 .
.
La réaction d’autoprotolyse
de l’eau est très peu avancée :
|
Si on raisonne sur un litre
d’eau :
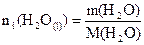
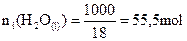
|

|
Le taux d’avancement de cette
réaction est 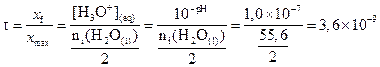 .
.
1.2.
Le produit ionique de l’eau
La réaction d’autoprotolyse
de l’eau peut avoir lieu dans les deux sens car on sait déjà que les ions
oxonium et les ions hydroxyde réagissent pour former deux molécules d’eau et
l’étude précédente indique que deux molécules d’eau peuvent réagir pour donner
un ion hydroxyde et un ion oxonium.
L’autoprotolyse de l’eau est
un équilibre chimique d’équation 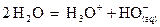 .
.
On associe à cette équation
une constante d’équilibre Ke appelée produit ionique de l’eau.
Comme la valeur de Ke
ne dépend pas de l’état initial du système, on a donc pour
toute solution aqueuse :
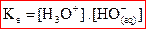 et à 25°C,
et à 25°C, 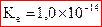 .
.
On utilise aussi  , soit
, soit 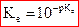 . À 25°C,
. À 25°C,
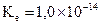 donc
donc  .
.
Expression de la concentration
des ions hydroxyde : 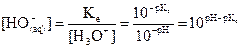 .
.
Rappel : comme toute
constante d’équilibre, Ke dépend de la température. (si T Z : Ke Z et pKe ])
1.3.
Échelle de pH
Solution neutre : les
concentrations des ions oxonium et hydroxyde sont égales. En général : 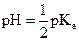 .
.
Solution acide : 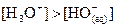 et à 25°C
et à 25°C 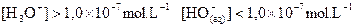 .
.
En général : une solution aqueuse est acide si 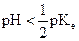 .
.
Solution basique : 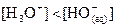 et à 25°C
et à 25°C 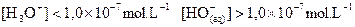 .
.
En général : une solution aqueuse est basique si 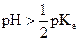 .
.
2.
Constante d’acidité d’un couple acide/base
2.1.
Définition
La constante d’acidité KA
du couple 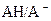 est la constante
d’équilibre associée à la réaction de l’acide AH avec l’eau.
est la constante
d’équilibre associée à la réaction de l’acide AH avec l’eau.
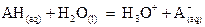
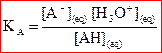
Ou 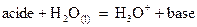

On
utilise la grandeur logarithmique pKA liée à la constante d’acidité
par  , soit
, soit 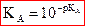 .
.
2.2.
Cas des couples acide/base de l’eau
Couple 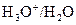 :
: 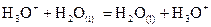 .
.
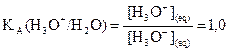
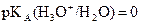 .
.
Couple 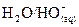 :
: 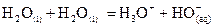 .
.
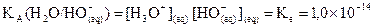
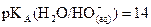 .
.
3.
Comparaison des acides et des bases
3.1.
Acides de même concentration
La force d’un acide traduit
sa capacité à céder un proton. Un acide est d’autant plus fort que la
concentration en ions oxonium est élevée.
On appelle acide fort une
espèce chimique qui présente une réaction 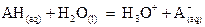 totale.
totale.
Un acide fort a un 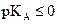 .
.
En solution aqueuse, l’acide
le plus fort est l’ion oxonium 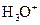 (
(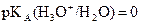 ).
).
Conséquences :
Pour 2 acides A1H
et A2H de même concentration initiale
en soluté apporté, l’acide le plus fort est celui :
· qui a le taux d’avancement final le plus élevé (si t1 > t2 alors A1
plus fort que A2).
· dont la solution a le pH le plus petit (si pH1 < pH2
alors A1 plus fort que A2).
· dont la constante d’acidité est la plus grande (si 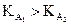 alors A1
plus fort que A2).
alors A1
plus fort que A2).
· dont le pKA est le plus petit (si 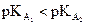 alors A1
plus fort que A2).
alors A1
plus fort que A2).
Preuves : (de 3 et 4
)
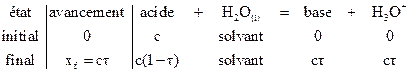
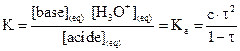
Si l’acide A1 est
plus fort que l’acide A2, on a t1 > t2.
Car 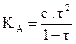 est une fonction
croissante de t, si t1 > t2 on a
alors
est une fonction
croissante de t, si t1 > t2 on a
alors 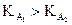 et
et 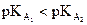 .
.
Un acide est d’autant plus forte que la constante d’acidité du couple
auquel elle appartient est plus grande et donc que le pKA du couple
est plus petit.
3.2.
Bases de même concentration
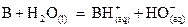 ou
ou 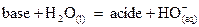
La force d’une base traduit
sa capacité à fixer un proton.
Une base est d’autant plus
forte que la concentration en ions hydroxyde est élevée.
On appelle base forte une
espèce chimique qui présente une réaction 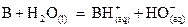 ou
ou 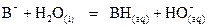 totale.
totale.
Une base forte a un 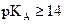 .
.
En solution aqueuse, la base
la plus forte est l’ion hydroxyde 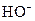 (
(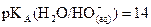 ).
).
Conséquences :
Pour 2 bases B1 et
B2 de même concentration initiale en
soluté apporté, la base la plus forte est celle :
· qui a le taux d’avancement final le plus élevé (si t1 > t2 alors B1
plus forte que B2).
· dont la solution a le pH le plus grand (si pH1 > pH2
alors B1 plus forte que B2 car 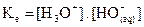 est constant.)
est constant.)
· dont la constante d’acidité est la plus petite (si 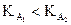 alors B1 plus fort que B2).
alors B1 plus fort que B2).
· dont le pKA est le plus grand (si 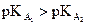 alors B1 plus fort que B2).
alors B1 plus fort que B2).
Preuves : (de 3 et 4
)
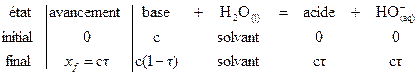
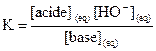
On multiplie le numérateur et
le dénominateur de la constante d’équilibre par 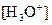 :
: 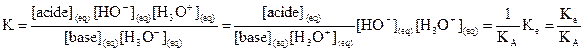
Si la base B1 est
plus forte qu’une base B2, on a t1 > t2.
Comme 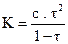 est une fonction
croissante de t, si t1 > t2 on a
alors
est une fonction
croissante de t, si t1 > t2 on a
alors 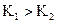 ce qui entraîne
ce qui entraîne 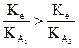 et donc
et donc 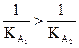 soit :
soit : 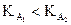 et
et 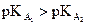 .
.
Une base est d’autant plus forte que la constante d’acidité du couple
auquel elle appartient est plus petite et donc que le pKA du couple
est plus grand.
4.
Constante d’équilibre associée à une réaction acido-basique
Les réactions précédentes
étaient des réactions acido-basiques dont l’un des couples acide/base contenait
l’eau. On généralise ici les résultats obtenus à une réaction entre deux couples
acide/base quelconques.
4.1.
Relation entre la constante d’équilibre et les constantes d’acidité
acide 1 + base 2 = base 1 + acide 2. 
On multiplie le numérateur et
le dénominateur de la constante d’équilibre par 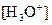 :
:  .
.
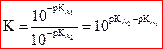 .
.
4.2.
Détermination du sens favorisé d’une transformation acido-basique
Cf. § 4.2. page 121 pour
trois exemples.
L’ordre de grandeur de la
constante d’équilibre permet de savoir si la réaction est totale, équilibrée ou
quasi inexistante.
Attention : Ceci
n’est valable que pour une réaction entre un monoacide et une monobase.
Ne l’employer pour d’autre réaction que si tous les nombres stœchiométriques valent 1.
· Si 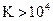 , soit
, soit 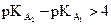 , la transformation est considérée totale dans le sens de
gauche à droite.
, la transformation est considérée totale dans le sens de
gauche à droite.
(La concentration des
produits est au moins 100 fois supérieure à celle des réactifs.)
· Si 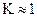 , soit
, soit 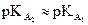 , la transformation est un équilibre.
, la transformation est un équilibre.
(La concentration des
produits est du même ordre de grandeur que celle des réactifs.)
· Si 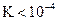 , soit
, soit 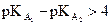 , la transformation est considérée totale dans le sens de
droite à gauche, ou quasiment inexistante dans le sens de gauche à droite.
, la transformation est considérée totale dans le sens de
droite à gauche, ou quasiment inexistante dans le sens de gauche à droite.
(La concentration des
produits est au moins 100 fois inférieure à celle des réactifs.)
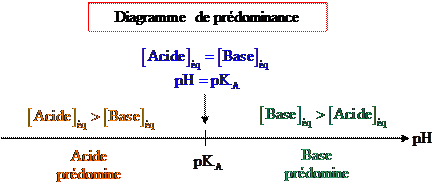
5.
Diagramme de prédominance
Une espèce chimique est
prédominante devant une autre si sa concentration dans la solution est
supérieure à celle de l’autre espèce.
Une espèce chimique est
majoritaire devant une autre si sa concentration dans la solution est 10 fois
supérieure à celle de l’autre espèce.
5.1.
Relation entre pH et pKA
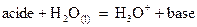
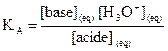
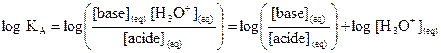
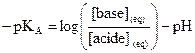 et
et
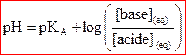 .
.
5.2.
Domaine de prédominance
La relation précédente permet
de définir trois zones de l’échelle de pH.
· Si 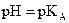 , alors
, alors 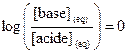 , ce qui entraîne
, ce qui entraîne 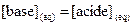 .
.
Lorsque 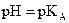 , les concentrations des deux espèces conjuguées sont égales.
, les concentrations des deux espèces conjuguées sont égales.
· Si 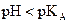 , [base] < [acide], la forme acide prédomine.
, [base] < [acide], la forme acide prédomine.
· Si 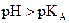 , [base] > [acide], la forme basique prédomine.
, [base] > [acide], la forme basique prédomine.
5.3.
Diagramme de distribution
Cas général :
Exprimons le rapport de la
concentration de chaque forme A et B par rapport à la concentration initiale.
Pour une solution de
concentration c contenant les espèces conjuguées A(aq) et B(aq)
on a : c = [A(aq)] + [B(aq)] et 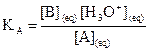 . On en déduit
. On en déduit 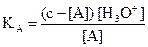 et
et 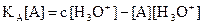 .
.
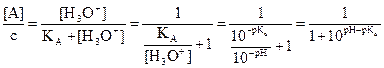 .
.
En procédant de même, on
trouve 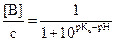 .
.
Les rapports 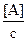 et
et 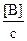 sont les fractions
centésimales molaires de A et B.
sont les fractions
centésimales molaires de A et B.
On peut multiplier ces
résultats par 100 pour les exprimer en %.
Les courbes 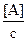 et
et 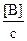 se coupent au point
d’abscisse pH = pKA.
se coupent au point
d’abscisse pH = pKA.
Pour pH < pKA,
la forme acide A prédomine et pour pH < pKA – 1
la forme basique est quasiment absente.
Pour pH > pKA,
la forme basique B prédomine et pour pH > pKA + 1
la forme acide est quasiment absente.
Preuve : 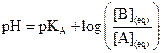
A
est majoritaire si 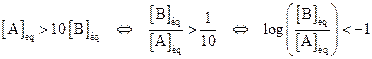 donc
donc 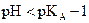
B
est majoritaire si 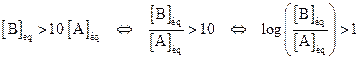 donc
donc 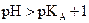
Les deux formes d’un couple acide/base ne coexistent en quantités du
même ordre de grandeur que pour un faible domaine du pH autour de la valeur du
pKA du couple : pKA – 1 < pH < pKA + 1.
Diagramme du couple acide
éthanoïque/ion éthanoate pKA = 4,8.
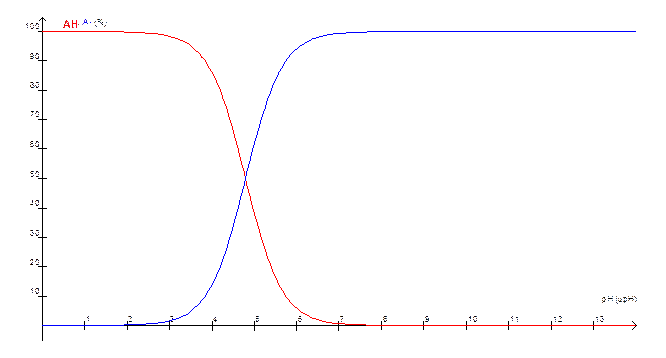
Le point d’abscisse
pH = pKA est tel que [acide] = [base].
5.4.
Cas des indicateurs colorés
Rappels de 1ère
S : les indicateurs colorés sont des couples acide/base particulier pour
lesquels la forme acide et la forme basique n’ont pas la même couleur.
Teinte sensible : c’est
la teinte intermédiaire résultant de la présence simultanée en quantités
proches des formes acide et basique de l’indicateur.
En première approximation,
une des formes acide ou basique de l’indicateur coloré impose sa couleur au
mélange si la concentration de cette forme est 10 fois plus grande que celle de
l’autre.
En appliquant les résultats
obtenus dans le cas général, on en déduit que la zone de virage d’un indicateur
coloré dépend du pKA du couple IndH/Ind- et la zone de teinte sensible s’étend
approximativement à ± 1 unité de pH autour de la valeur du pKInd de
l’indicateur.
Si pH < pKA – 1,
la couleur est celle de la forme acide A qui prédomine.
Si pH > pKA + 1,
la couleur est celle de la forme basique B qui prédomine.
En réalité, la zone
de virage est souvent plus réduite car il faut tenir compte du pouvoir colorant
de chacune des formes en présence et de la sensibilité de l’œil à la couleur.

![]() .
.![]() .
.![]() .
.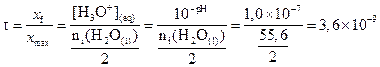 .
.![]() .
.![]() et à
et à ![]() .
.![]() , soit
, soit ![]() . À
. À ![]() donc
donc ![]() .
.![]() .
.![]() .
.![]() et à
et à ![]() .
.![]() .
.![]() et à
et à ![]() .
.![]() .
.![]() est la constante
d’équilibre associée à la réaction de l’acide AH avec l’eau.
est la constante
d’équilibre associée à la réaction de l’acide AH avec l’eau. ![]()
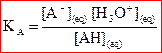
![]()

![]() , soit
, soit ![]() .
.![]() :
: ![]() .
.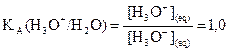
![]() .
.![]() :
: ![]() .
.![]()
![]() .
.![]() totale.
totale.![]() .
.![]() (
(![]() ).
).![]() alors A1
plus fort que A2).
alors A1
plus fort que A2).![]() alors A1
plus fort que A2).
alors A1
plus fort que A2).
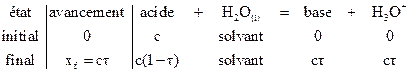
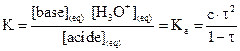
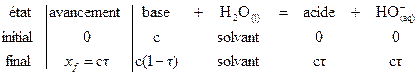
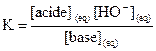
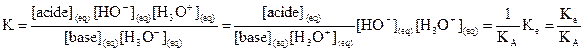

 .
.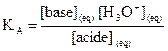
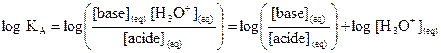
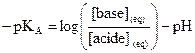
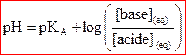 .
.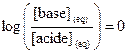 , ce qui entraîne
, ce qui entraîne 
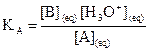 . On en déduit
. On en déduit 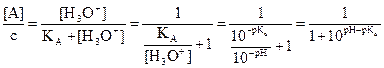 .
.