|
L'élève doit être capable de (d'):
• décrire le mécanisme de la dissolution des
composées ioniques ou moléculaires
• expliquer la faible conductivité de l'eau pure
• écrire l'équilibre d'autoprotolyse de l'eau:
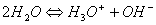
• définir le produit ionique de l'eau:
Ke = [H3O+] [OH-]et retenir sa valeur à 25°:
Ke = 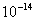
• rappeler la définition du pH:
pH = -log [H3O+] ou
[H3O+] = 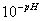
|
Acide et base en solution aqueuse
• L'eau solvant ionisant, produit ionique, pH
des solutions
aqueuses
|
Durée: 03 heures
• On pourra commencer par la géométrie de la
molécule d'eau et sa polarité, afin d'aboutir à l'explication de la
dissolution.
• La faible conductivité électrique de l'eau pure
sera expliquée par la présence des ions H3O+ et OH- en faible quantité.
• En bref, ce chapitre a pour but de rappeler
les notions déjà vues en seconde: pH de l'eau pure, autoprotolyse de l'eau,
solutions acides, basiques, neutres...
|
|
• tester la présence des ions H3O+ et Cl- dans
les solutions chlorhydriques
• écrire correctement la réaction du chlorure
d'hydrogène avec l'eau:
H Cl + H2O —> H3O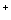 + Cl- + Cl-
• appliquer la formule du pH de l'HCl: pH=-logCA
valable pour
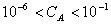
• écrire la réaction d'un acide fort avec l'eau
• écrire correctement la réaction de la soude
avec l'eau
• mettre en évidence les ions Na4" et OH'
dans les solutions d"hydroxyde
de sodium
• appliquer la formule du pH de la soude de
concentration CB:
pH = 14 + log C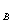 , valable pour , valable pour 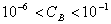
• écrire la réaction d'une base forte avec l'eau
• citer des exemples d'acide fort et de base
forte
|
Les solutions aqueuses d'acide
chlorhydrique et d'hydroxyde de sodium: pH de ces solutions
|
Durée: 04 heures
• Dans ce chapitre on fera comprendre ce qu'est
un acide fort ou une base forte.
• On montrera l'aspect total de la réaction,
entre le chlorure d'hydrogène et l'eau:
- premièrement, par une expérience qualitative
de conductibilité d'une solution d'acide chlorhydrique.
- deuxièmement, quantitativement, par mesure
pH- métrique de cette solution
• On traduira correctement cette dissolution
par une équation chimique.
• II est souhaitable d'établir
expérimentalement la formule: pH = -log C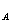 que les élèves devront connaître, on précisera la validité de cette
relation. que les élèves devront connaître, on précisera la validité de cette
relation.
• On généralisera le résultat précédent à toute
solution d'acide fort.
(même cheminement pour l'étude de la solution
de soude et les bases fortes)
|
|
• définir un couple acide-base et citer
quelques propriétés correspondantes
• écrire les formules:
a) des couples acide/base suivants:
- acide éthanoïque/ion éthanoate
- acide méthanoïque/ion méthanoate
acide monochloroéthanoïque/ion
monochloroéthanoate
- ion ammonium/ammoniac
- ions méthylammonium/
méthylamine
- ion éthylammonium/
éthylamine
b) des acides forts suivants: HC1, HNO3, HBr, HI, H2SO4
c) des bases fortes:
NaOH, KOH, Ca(OH)2, C2H5O-
• écrire correctement la réaction d'un acide
faible avec l’eau
• définir la constante d'acidité pour un couple
acide/base, A/B
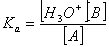
• classifier les couples acide-base suivant Ka
ou pKa
• tracer l'échelle de dominance pour un couple
A/B
• citer le nom et le pKa des trois principaux indicateurs colorés:
- hélianthine pKa = 3,4
- B.B.T. pKa
= 6,8
- phénolphtaléine pKa = 9,4
|
Couples acide-base
• Définition des couples acide-base, exemples
• Définition de la constante d'acidité Ka;
applications:
- classification des couples acide-base,
- domaine de prédominance de la forme acide et
forme basique,
- les indicateurs colorés acido- basiques
|
Durée: 06 heures
• On mettra en exergue l’analogie formelle avec
la définition du couple oxydant-réducteur vue en 1ères C et D.
• Dans ce chapitre, on fera comprendre ce que
sont un acide faible et une base faible.
• On montrera l'aspect limité et réversible, de
la réaction de l'acide éthanoïque avec l'eau:
- premièrement/par les expériences qualitatives
sur la conductibilité comparée des solutions d'acide éthanoïque et d'acide chlorhydrique
de même concentration,
- deuxièmement, quantitativement, par mesure
pH-métrique de différentes solutions d'acide éthanoïque.
La valeur mesurée du pH permet d'avoir accès
aux concentrations et au "degré d'ionisation" de l'acide.
• On fera remarquer que le degré d'ionisation
est faible pour cet acide.
• On définira les acides et les bases de
Bronsted, puis on explicitera que les réactions de CH3 COOH et CH3 COO- avec
l'eau consistent en un transfert de protons.
• Le couple NH4+/NH3 sera étudié de la même
façon que celui de CH3COOH/CH3COO-
• On donnera sans démonstration la constante
d'acidité Ka, qui peut s'écrire également sous la formule d'HENDERSON
pKa=pH+log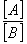
• On ne parlera pas de la constante Kb qui
existe seulement en théorie d'Arrhénius,
mais n'intervient pas en théorie de Bronstëd.
• On fera comprendre le mécanisme de
fonctionnement d'un indicateur coloré, à partir des zones de dominance de
l'acide et de la base, de part et d'autre de pH = pKa.
|
|
• écrire correctement les équations-bilans dans
les trois cas suivants:
- acide faible + base forte
- base faible + acide fort
- acide fort + base forte
• tracer et analyser les courbes de variation
du pH
• justifier qu'au point d'équivalence
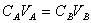
• définir les solutions tampons, leurs
propriétés et leurs importances
• donner le principe d'un dosage acide-base:
- bilan réactionnel,
- relation caractérisant le point d'équivalence
- repérage du point d'équivalence
• mettre en œuvre le mode opératoire:
- calculer la concentration molaire inconnue en
utilisant les résultats expérimentaux
- choisir l'indicateur coloré le mieux adapté.
|
Réaction acide base dans les cas suivant :
• Acide faible+base
forte
• Base faible + acide fort
• acide fort + base forte
• Courbe de variation du pH
• Effet tampon
• Dosages
|
Durée: 10 heures
• On analysera la courbe donnant l'évolution du
pH d'une solution d'acide éthanoïque de concentration proche de lO mol.l mol.l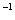 , lorsque l’on y verse , lorsque l’on y verse
une solution d’hydroxyde de sodium de même
concentration.
• On fera remarquer qu'au point d'équivalence,
la quantité d'ions OH- versés est égale à la quantité de molécules CH3COOH
initialement présentes et le pH est supérieur à 7.
• A la demi-équivalence, la quantité d'ions OH-
versés est la moitié de celle qui est introduite à l'équivalence et le pH est
égal au pKa du couple
CH3COOH/CH3COO-.
• On profitera de l'analyse des courbes pour
définir les solutions tampons, leurs pro-
priétés, et leurs intérêts.
• Même cheminement pour la solution d'ammoniac
de concentration proche de 10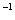 mol. mol.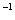 lorsque l'on y verse une solution d'acide chlorhydrique de même
concentration. lorsque l'on y verse une solution d'acide chlorhydrique de même
concentration.
• La méthode des tangentes sera aussi donnée
pour déterminer le point d'équivalence.
• La notion de normalité ne sera plus utilisée.
• Le choix de l'indicateur coloré sera raisonné.
|