titrages acidobasiques
|
|
titrages acidobasiques |
C 6 TP |
Compte rendu
Source : Lydie Germain, lycée Clémenceau, Reims
Titrage du vinaigre
Questionnaire 1 :
1°/ Calculer la concentration en acide éthanoïque d’un vinaigre à 6°. (La densité du vinaigre est d » 1).
Si la densité vaut 1, la masse d’un litre de vinaigre est égale à 1 kg. ![]() .
.
La concentration en acide éthanoïque du vinaigre est
![]() .
.
![]() .
.
2°/ Pourquoi ne peut-on pas titrer directement, par pH-métrie, l’acide éthanoïque contenu dans ce vinaigre ?
On ne peut pas titrer directement par pH-métrie des solutions dont les concentrations sont supérieures à ![]() (dans la pratique on évite de doser des solutions de concentration supérieures à
(dans la pratique on évite de doser des solutions de concentration supérieures à ![]() ), car les limites de mesures des électrodes sont atteintes.
), car les limites de mesures des électrodes sont atteintes.
Questionnaire 2 :
3°/ Écrire l’équation de la réaction de dosage.
.
![]()
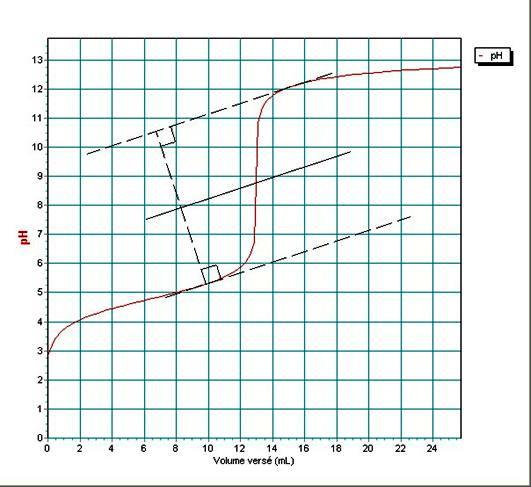
4°/ Déterminer le point d’équivalence sur les deux courbes en rappelant les méthodes utilisées.
Méthode des tangentes pour la courbe ![]() .
.
Le point d’équivalence se trouve à VBE=12,8mL et pH » 8,7.
5°/ Calculer la concentration ![]() en acide éthanoïque du vinaigre.
en acide éthanoïque du vinaigre.
![]() et
et ![]() donc
donc
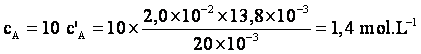 .
.
6°/ En déduire le degré d’acidité du vinaigre. Vérifier l’indication de l’étiquette de la bouteille.
Le degré d’acidité d’un vinaigre est la masse d’acide acétique pur contenu dans 100 g de vinaigre.
Si le densité du vinaigre vaut 1, 100 g de vinaigre a un volume de 100 mL.
La quantité d’acide éthanoïque dans ce volume est 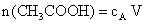
La masse d’acide éthanoïque dans ce volume est ![]()
et cela correspond au degré d’acidité du vinaigre.
A.N. : ![]()
Cette valeur est proche de l’indication de l’étiquette 8°.
7°/ Quel est le meilleur indicateur coloré pouvant convenir pour réaliser ce dosage ?
Le pH à l’équivalence est 8,7, cette valeur doit être incluse dans la zone de virage de l’indicateur coloré.
On choisit dons la phénolphtaléine.
Titrage des ions hydrogénocarbonate d’une eau minérale
1°/ Écrire l’équation de la réaction de dosage.
![]()
2°/ Déterminer le point d’équivalence.
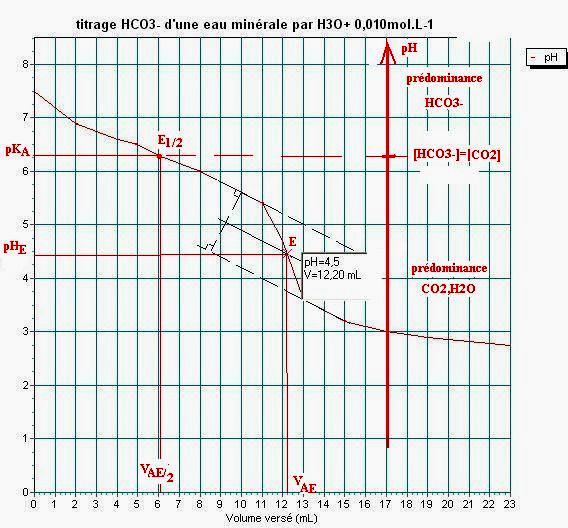
Méthode des tangentes, VAE=12,2mL, pHE=4,5.
3°/ Calculer la concentration en ion hydrogénocarbonate de l’eau dosée.
En déduire la concentration massique en ion hydrogénocarbonate de cette eau minérale.
Comparer avec la valeur indiquée sur l’étiquette.
![]()
![]()
Concentration massique :
![]()
![]()
Soit 372mg.L-1, or l’étiquette indique ![]() , le résultat trouvé est proche (avec 7% d’erreur).
, le résultat trouvé est proche (avec 7% d’erreur).
4°/ Établir le diagramme de prédominance des espèces chimiques :![]() ,
, ![]() et
et ![]() .
.
En déduire l’espèce majoritaire en solution avant l’équivalence puis après l’équivalence.
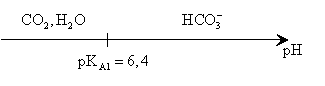

Avant l’équivalence, il y a deux cas à considérer :
pH>pKA1, l’espèce majoritaire est HCO3-.
4,5<pH<pkA1 l’espèce majoritaire est ![]() .
.
Après l’équivalence, le pH est inférieur à 4,5, l’espèce majoritaire est ![]() .
.
5°/ Pour quel volume d’acide chlorhydrique versé a-ton ![]() ? Quelle relation y-a-t-il antre ce volume et le volume versé à l’équivalence ? Comment peut-on déterminer expérimentalement le
? Quelle relation y-a-t-il antre ce volume et le volume versé à l’équivalence ? Comment peut-on déterminer expérimentalement le ![]() du couple
du couple ![]() ?
?
On aura ![]() si
si ![]() donc quand
donc quand ![]() c'est-à-dire quand l’avancement est égale
c'est-à-dire quand l’avancement est égale 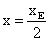 donc
donc ![]() , c’est la demi équivalence.
, c’est la demi équivalence.
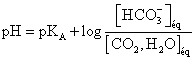 et si
et si ![]() alors
alors ![]() quand
quand ![]() .
.
6°/ Quel est le meilleur indicateur coloré pouvant convenir pour réaliser ce dosage ?
Le pH à l’équivalence est ![]() , ce pH doit être dans la zone de virage de l’indicateur coloré, il faut donc utiliser le vert de Bromocrésol.
, ce pH doit être dans la zone de virage de l’indicateur coloré, il faut donc utiliser le vert de Bromocrésol.